Nadine Lübke, Düsseldorf
INSTI-Resistenz auf dem Vormarsch?
Die Prävalenz von Resistenzen gegen INSTI der zweiten Generation ist gering, steigt aber insbesondere in Ländern mit begrenzten Ressourcen an. Die WHO empfiehlt daher ein routinemäßiges Resistenzmonitoring, um die Ausbereitung resistenter Varianten zu verhindern.
Die Integrasehemmer (INSTI) zeichnen sich nicht nur durch eine ausgezeichnete antivirale Aktivität aus, sondern auch durch eine sehr gute Verträglichkeit, so dass sie sehr schnell in die nationalen und internationalen Empfehlungen zur antiretroviralen Therapie aufgenommen wurden. Allerdings weisen die Integrasehemmer der ersten Generation eine niedrige Resistenzbarriere auf. Es kann schnell zur Selektion resistenter Virusvarianten und damit zum virologischen Versagen kommen. Erst die Weiterentwicklung der INSTI der zweiten Generation mit einer verlängerten intrazellulären Halbwertszeit, die eine einmal tägliche Gabe ohne Boosterung ermöglicht, und einer hohen Resistenzbarriere und gleichzeitig einer guten Verträglichkeit, resultierte in einer stabilen Virussuppression auch bei INSTI-erfahrenen Personen.
Weltweit Standard
Der erste Integrase Inhibitor der sogenannten zweiten Generation Dolutegravir (DTG) wurde 2013 von der FDA und ein Jahr später auch von der EMA für die Behandlung therapienaiver und therapieerfahrener HIV-1-Infizierter zugelassen. Die Substanz hat sich sehr schnell etabliert und wird seit 2018 von der WHO als Bestandteil jeder HIV-Erstlinientherapie als bevorzugte Substanz für HIV-Sekundärtherapien empfohlen. Der zweite INSTI der zweiten Generation Bictegravir (BIC) wurde 2018 zugelassen und steht nur als Fixkombination mit TDF/FTC zur Verfügung.
INSTI-Resistenz
Ein virologisches Versagen unter einem DTG-haltigen Therapieregime ist ein seltenes Ereignis. Es wurden bisher nur einige wenige Fälle beschrieben. Die häufigsten Resistenzmutationen, die bei Personen unter INSTI-haltiger Therapie beobachtet wurden, waren T66A/I/K, E92G/Q, G118R, F121Y, E138A/K/T, G140A/C/S, Y143C/H/R/S, S147G, Q148H/R/K, N155H, S230R und R263K.1 Diese Mutationen wurden als relativ häufig vorkommende nicht-polymorphe Mutationen identifiziert, die durch die INSTI-Behandlung signifikant selektiert werden. Sie eignen sich daher für die Überwachung der übertragenen INSTI- Resistenz.
Eine
Therapie mit einem INSTI der ersten Generation wie Raltegravir oder
auch Elvitegravir führt bei nicht ausreichendem Selektionsruck neben
dem virologischen Versagen in der Regel zur Selektion von resistenten
Virusvarianten. Dies ist bei einer Therapie mit den INSTI der zweiten
Generation, also Dolutegravir oder Bictegravir, ein seltenes
Ereignis. Resistenz gegenüber INSTI der ersten Generation wie
Raltegravir ist mit den Mutationen N155H, Q148H und Y143R als „major
mutations“ in der HIV-1-Integrase assoziiert. INSTI der zweiten
Generation weisen aufgrund ihrer unterschiedlichen
Bindungsinteraktionen mit dem Integrase-Enzym eine höhere genetische
Resistenzbarriere auf. Zu den Mutationen, die häufig mit einer
Resistenz gegen INSTI der zweiten Generation in Verbindung gebracht
werden, gehören R263K, G118R oder auch die E138K Mutation.2,
3 Diese
Unterschiede
verdeutlichen, wie wichtig es für effektive
HIV-Behandlungsstrategien ist, die spezifischen Resistenzprofile der
verschiedenen Generationen von INSTI zu verstehen, um ein vorzeitiges
Therapieversagen zu vermeiden.
Resistenz in Deutschland
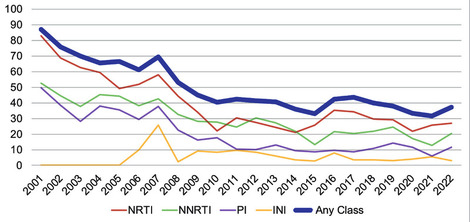
Abb. 1 Prävalenz (%) der Resistenz bei therapieerfahrenen PLWH (Personen, die mit HIV leben) aus dem AREVIR-Projekt (Böhm M. et al., DÖAK 2023)
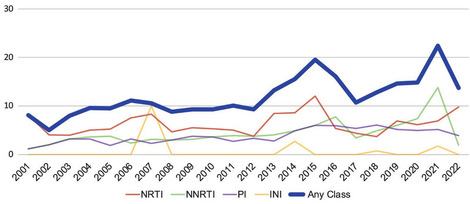
Abb. 2 Prävalenz (%) von Resistenzen bei therapienaiven PLWH (Personen, die mit HIV leben) aus der RESINA-Studie (Böhm M. et al., DÖAK 2023)
Eine Auswertung der RESINA-Kohorte, einer seit 2001 in Nordrhein-Westfalen laufenden prospektiven Studie zur Evaluation von Primärresistenzen, zeigt eine seit 2008 stabile Prävalenz von INSTI-Mutationen bei therapie-erfahrenen Personen von <10% (Abb. 1). Diese im Vergleich zu anderen Substanzklassen niedrige Resistenzprävalenz spiegelt sich auch in der geringen INSTI-Primärresistenz-Rate von <2% bei neu HIV-Infizierten wieder (Abb. 2).
Diese niedrige Prävalenz konnte auch im Rahmen der molekularen Surveillance der Primärresistenzen in Deutschland bestätigt werden.4 Zwischen 2017 und 2020 lag die Prävalenz von Primärresistenzen bei rund 10%. Der Anteil an INSTI Resistenzen lag auch hier stabil <2%.4 Was jedoch sowohl in der RESINA Studie wie auch in der molekularen Surveillance beobachtet wurde, war eine Zunahme von NNRTI-Resistenzen und zwar vor allem der NNRTI-Mutation K103N, der klassischen Efavirenz-Resistenzmutation.
Resistenz in Europa
Betrachtet man die Resistenzsituation in Europa oder auch global kann man deutlich regionale Unterschiede feststellen. Während innerhalb Europas zwischen 2008 und 2018 in Italien und Luxemburg eine Abnahme der übertragenen Resistenzen beobachtet wurde (10,9% → 8,8%; 16,8% → 13,8%), kam es in Deutschland und Portugal zu einer Zunahme (9,9% → 11,9%; 9,1% →13,9%).5 Die Prävalenz von primären INSTI-Mutationen ist europaweit dennoch gering (0,3%) und hat keinen relevanten Einfluss auf die Wirksamkeit der INSTI der zweiten Generation.6
Resistenzlage global
Betrachtet man die Resistenzsituation in Ländern mit begrenzten Ressourcen, so zeigen sich ebenfalls regionale Unterschiede. In allen Ländern dominierten NNRTI-Resistenzen gegen EFV und Nevirapin (NVP), vor allem die Mutation K103N.7 Die erworbenen NNRTI-Resistenzen reichen von 50% in Lesotho oder Vietnam im Jahr 2018 bzw. 2020 bis zu 97% in Uganda im Jahr 2016. Diese hohe Prävalenz von NNRTI-resistenten Virusvarianten in der HIV-positiven Bevölkerung spiegelt sich auch in der Prävalenz der übertragenen Resistenzen wider. Die HIV-Medikamentenresistenz gegen NVP oder EFV erreicht in den Bevölkerungsgruppen, die eine Erstlinien-ART beginnen, Werte von über 10%.
Zur
Prävalenz der primären Resistenz gegen INSTI liegen für den
Zeitraum 2014-2020 nur Daten aus 10 Ländern vor, aus drei
afrikanischen und sieben mittel- und südamerikanischen Ländern.
Insgesamt war die Prävalenz von Resistenzen gegen die INSTI der
zweiten Generation DTG und BIC sowie dem „long acting“ INSTI
Cabotegravir (CAB-LA) vor Beginn der ART sehr niedrig (≤0,4%). Im
Gegensatz dazu lag die durchschnittliche Prävalenz von Resistenzen
gegen die INSTI der ersten Generation (RAL, EVG) bei rund 2,3% –
allerdings mit starken
regionalen Unterschieden (2,3%, 95% CI
0,0-5,5%).7
Die geringe Prävalenz der DTG-Resistenz wird auch dadurch deutlich, dass >90% der Populationen, die eine DTG-haltige ART erhalten, eine stabile Virussuppression aufweisen und somit ein geringes Risiko für die Resistenzentwicklung besteht.8, 9
DTG-Resistenz steigt
Neuere
Beobachtungsdaten, die auf der CROI 2024 vorgestellt und auch im
diesjährigen „HIV drug resistance report“ der WHO berichtet
wurden, zeigen jedoch, dass die DTG-Resistenzraten im „real-world“
Setting
höher sind als in klinischen Studien. Obwohl nach wie
vor nur aus wenigen Ländern berichtet wird, dass unter einer
DTG-haltigen ART keine Virussuppression erreicht wird, wurden
DTG-Resistenzraten zwischen 3,9% und 8,6% beobachtet. Bei stark
vorbehandelten Personen, die bei hoher HIV-Viruslast auf eine
DTG-haltige ART umgestellt wurden, wurde sogar eine Resistenzrate von
19,6% dokumentiert.9-12
Diese Untersuchungen erfolgten jedoch nicht im Rahmen eines
systematischen Screenings und sind daher nur sehr lückenhaft.
Dennoch haben diese Beobachtungen
die Aufmerksamkeit erhöht,
sodass diese Entwicklung weiter beobachtet wird.
Transmission INSTI-Resistenz
Die niedrige Prävalenz von übertragenen INSTI-Mutationen hat verschiedene Ursachen: (1) die hohe genetische Barriere für Resistenzen bei INSTI der zweiten Generation; (2) die geringere Fitness von Viren mit Resistenzmutationen; (3) die stabile Virus-Suppression unter INSTI-haltigen Therapieregimen. INSTI der zweiten Generation wie Dolutegravir haben eine höhere Resistenzbarriere als INSTI der ersten Generation, wodurch das Entstehen resistenter Stämme eingeschränkt wird. Darüber hinaus wird die Wahrscheinlichkeit der Übertragung resistenter Viren durch die strikte Einhaltung der antiretroviralen Therapie und eine wirksame Virussuppression weiter verringert.
Dennoch ist in den letzten Jahren ein zunehmender Trend bei der Übertragung von INSTI-resistenten Virusvarianten zu beobachten9,13, der sich derzeit noch auf niedrigem Niveau befindet. Die Zunahme von INSTI-Resistenzen kommt nicht unerwartet. Der mittlerweile weltweite Einsatz von INSTI und die hohe Zahl von Personen unter einer INSTI-haltigen Therapie erhöhen natürlich auch die Wahrscheinlichkeit der Selektion von resistenten Virusvarianten und damit auch die Möglichkeit der Übertragung. Die WHO empfiehlt daher die Einführung eines routinemäßigen, standardisierten HIV-Resistenzmonitorings, um Prävalenz und Resistenzprofile zu verfolgen und so die frühzeitig die Ausbreitung resistenter Virusvarianten zu verhindern.9
INSTI-Resistenz und der Subtyp A6
Der
„long acting“ INSTI Cabotegravir (CAB-LA) wird in Kombination mit
dem lang wirksamen NNRTI Rilpivirin (RPV-LA) als „Injectables“
verabreicht. Diese lang wirksame Therapie ist unter bestimmten
Voraussetzungen eine sehr gute Alternative zur klassischen oralen
Therapie. Zum jetzigen Zeitpunkt scheint CAB/RPV-LA ein sehr
geeignetes Regime zu sein. Umso überraschender waren die Beobachtung
in klinischen Studien, dass es bei einigen wenigen Patienten mit dem
Subtyp A6 und der subtypassoziierten Mutation L74I zum
Therapieversagen kam. Diese Konstellation Subtyp A6 und L74I weist in
Deutschland nur eine kleine Minderheit von Personen die mit HIV leben
auf. Für diese Personen
bevorzugen wir in Düsseldorf derzeit
Alternativen zu CAB/RPV-LA bis die Datenlage eine genauere
Einschätzung der tatsächlichen Relevanz des HIV-1 Subtyps A6 in
Bezug auf eine möglicherweise reduzierte Sensitivität
gegenüber
CAB-LA erlaubt.14
CAB-LA PrEP
Der Einsatz von CAB-LA zur Präexpositionsprophylaxe (PrEP) reduziert das Risiko einer HIV-Infektion erheblich und war nach ersten Studienberichten einer Tabletten-basierten PrEP überlegen (HPTN 083, HPTN 084).15 In einigen Fällen wurde jedoch bei kürzlich erfolgter CAB-LA-Exposition eine INSTI-Resistenz beobachtet. Die verzögerte Erkennung und Bestätigung der HIV-Infektion erhöht das Risiko der Selektion von INSTI-assoziierten Mutationen.16 Da die HIV-Viruslast bei Personen unter CAB-LA PrEP jedoch meist niedrig ist, ist das Risiko einer Übertragung von INSTI-resistentem HIV wahrscheinlich gering. Dennoch sollte die Ausweitung der CAB-LA PrEP von einem standardisierten Monitoring der Medikamentenresistenz bei Personen begleitet werden, die während der PrEP positiv auf HIV getestet werden.
Da auch in der Substanzklasse der INSTI Kreuzresistenzen bekannt sind, ist ein Versagen der CAB-LA PrEP durch übertragene INSTI-resistente Virusvarianten durchaus möglich. Aufgrund der derzeit noch geringen Prävalenz von INSTI-Resistenzen ist die Wahrscheinlichkeit eines PrEP-Versagens aufgrund von INSTI-Resistenzen jedoch sehr gering und unterliegt damit dem Nutzen der PrEP.
Fazit
Die Integrasehemmer der zweiten Generation zeichnen sich durch eine hohe Wirksamkeit, eine sehr gute Verträglichkeit und ein geringes Risiko der Resistenzentwicklung aus. Diese Eigenschaften führen zu einer geringen Prävalenz von INSTI-resistenten Virusvarianten – auch wenn in den letzten Jahren ein Anstieg zu beobachten ist. Die Ausbreitung von INSTI-resistenten Viren wird durch die Resistenz-assoziierte verminderte virale Fitness erschwert. Dennoch empfiehlt die WHO die Einführung eines routinemäßige, standardisierten HIV-Resistenzmonitorings, um die Prävalenz und die Resistenzprofile zu verfolgen und so frühzeitig die Ausbreitung resistenter Virusvarianten zu verhindern.
1 Tzou, P.L., et al., Integrase strand transfer inhibitor (INSTI)-resistance mutations for the surveillance of transmitted HIV-1 drug resistance. J Antimicrob Chemother, 2020. 75(1): p. 170-182.
2 Lubke, N., et al., Failure of Dolutegravir First-Line ART with Selection of Virus Carrying R263K and G118R. N Engl J Med, 2019. 381(9): p. 887-889.
3 Telele, N.F., et al., Pretreatment drug resistance in a large countrywide Ethiopian HIV-1C cohort: a comparison of Sanger and high-throughput sequencing. Sci Rep, 2018. 8(1): p. 7556.
4 Fiebig, U., et al., Transmitted drug resistance and subtype patterns of viruses from reported new HIV diagnoses in Germany, 2017-2020. BMC Infect Dis, 2023. 23(1): p. 673.
5 Miranda, M.N.S., et al., Trends of Transmitted and Acquired Drug Resistance in Europe From 1981 to 2019: A Comparison Between the Populations of Late Presenters and Non-late Presenters. Front Microbiol, 2022. 13: p. 846943.
6 de Salazar, A., et al., Transmitted Drug Resistance to Integrase-Based First-Line Human Immunodeficiency Virus Antiretroviral Regimens in Mediterranean Europe. Clin Infect Dis, 2023. 76(9): p. 1628-1635.
7 WHO. HIV drug resistance report 2021. 2021; Available from: https://www.who.int/publications/i/item/9789240038608.
8 Skrivankova, V.W., et al. Viremia and Drug Resistance 2 Years After Routine Switching to Dolutegravir-Based First-Line ART. in CROI. 2024. Denver, Colorado.
9 WHO. HIV drug resistance – brief report 2024. 2024; Available from: https://www.who.int/publications/i/item/9789240086319.
10 Tschumi, N., et al. Emerging Dolutegravir Resistance in Lesotho. in CROI. 2024.
11 Kingwara, L., et al. DTG Resistance in Patients with Previous ARV Experience and Viremia in Kenya Receiving DTG-Based ART. in CROI. 2024.
12 Juárez-González, J.A., et al. Resistance to Second-Generation InSTIs in Mexican PLWH: Emergence of the R263K Mutant. in CROI. 2024.
13 Muccini, C., et al., Increasing trend of transmitted integrase inhibitor resistance in a cohort of antiretroviral therapy-naive people living with HIV. J Antimicrob Chemother, 2023. 78(5): p. 1314-1315.
14 Orkin, C., et al., Expanded Multivariable Models to Assist Patient Selection for Long-Acting Cabotegravir + Rilpivirine Treatment: Clinical Utility of a Combination of Patient, Drug Concentration, and Viral Factors Associated With Virologic Failure. Clin Infect Dis, 2023. 77(10): p. 1423-1431.
15 Liegeon, G. and J. Ghosn, Long-acting injectable cabotegravir for PrEP: A game-changer in HIV prevention? HIV Med, 2023. 24(6): p. 653-663.
16 Parikh, U.M., C.A. Koss, and J.W. Mellors, Long-Acting Injectable Cabotegravir for HIV Prevention: What Do We Know and Need to Know about the Risks and Consequences of Cabotegravir Resistance? Curr HIV/AIDS Rep, 2022. 19(5): p. 384-393.









 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen