Nils Von Hentig, Frankfurt
Long-acting ART: Welche Rolle spielt Therapeutisches Drug Monitoring?
In einer der Zulassungsstudien zur Long-acting ART (LA-ART) mit Cabotegravir und Rilpivirin kam es nach 152 Wochen bei 1,4% der Patient*innen zum virologischen Versagen, was in einigen Fällen zu einer Klassenresistenz gegen Integrasehemmer führte. Als Ursachen für dieses Therapieversagen wurden zunächst ein hoher BMI (ein bekanntes Problem bei i.m. Injektionen) sowie der HIV-Subtyp A1/A6 identifiziert. Um vorherzusagen, welche Patientenbesser nicht mit LA-ART behandelt werden sollten bzw.nach Beginn der Therapie engmaschig kontrolliert werden sollten, wurde ein multivariates Vorhersagemodell berechnet, in das vorliegende virologische Daten (HIV-Subtyp, Resistenzen zum Zeitpunkt der Baseline sowie des Therapieversagens), Plasmakonzentrationen von Cabotegravir/Rilpivirin (Ctau, gemessen alle 8 Wochen vor der jeweiligen Injektion) sowie Patientencharakteristiken (u.a. BMI) eingingen.1
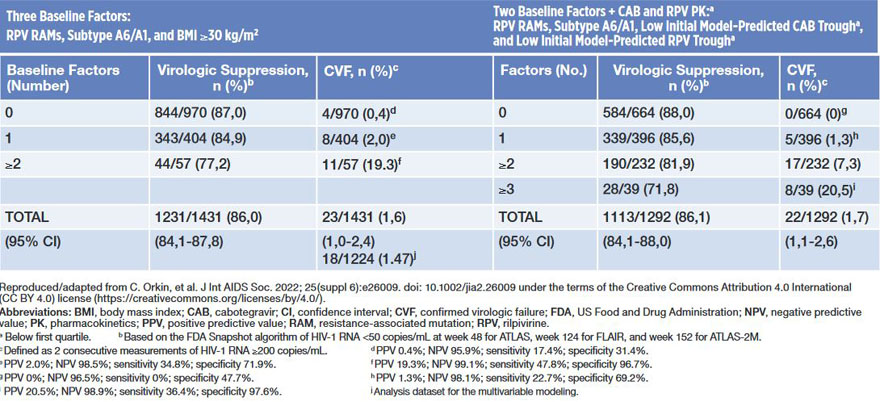
Tab. 1 Virologic Outcomes by the Presence of Key Baseline and Postbaseline Factors (Orkin et al., 2023)
Prädiktiv für Versagen?
Im Ergebnis wurden drei Faktoren identifiziert, die ein Therapieansprechen bzw. -versagen begünstigen sollen:
- Rilpivirin-Resistenzmutationen im HI-Virus zu Baseline (Adjusted Incidence Ratio, AIR, 21,7, p<.001),
- HIV A1/A6-Subtyp (AIR 12,9, p<.001) und
- ein BMI ≥30 kg/m² (AIR 1,09, p=.045).
Bei Vorliegen von ≥2 dieser Faktoren würde die Therapie zu einem virologischen Versagen führen. Was sich logisch anhört, relativiert sich allerdings beim Betrachten der Fußnote zu Tabelle 1 der Publikation: „Im besten Vorhersagemodell beträgt die Sensitivität 99,1% und die Spezifität 47,8%.“ Das Modell sagt also mit hoher Sicherheit vorher, bei welchen Patient*innen die Therapie versagen wird, jedoch mit einer weniger als 50%igen Wahrscheinlichkeit, bei wem die Therapie erfolgreich sein wird. Ausdruck dessen ist die im Artikel nicht dargestellte, grafische Darstellung der BMI-Verteilung. Diese Grafik in der Publikation von Cutrell aus dem Jahr 2021 zeigt, dass Patient*innen mit Therapieversagen in den meisten Fällen zwar einen hohen BMI und niedrige Plasmakonzentrationen von Rilpivirin hatten, jedoch auch >50% derjenigen, die erfolgreich behandelt wurden, ebenfalls diese Werte aufwiesen (Abb. 1).2
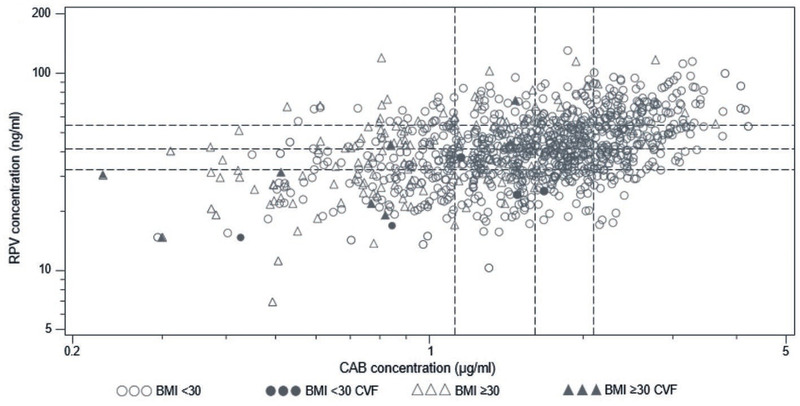
Abb. 1 Korrelation von Medikamenten-Spiegel und Therapieansprechen/-versagen
Die dunklen Dreiecke bzw. Kreise markieren Patient*innen, bei denen die ART virologisch versagt hat, die hellen Dreiecke bzw. Kreise diejenigen, in denen die ART erfolgreich war.
Wenig klinische Daten
Solche Modellrechnungen sind in der Regel darauf angelegt, in einem von beiden Parametern nahe 100%, im anderen >80% zu erreichen, um eine klinisch relevante Aussage treffen zu können. Die Berechnung scheitert allerdings, wenn zu wenige klinisch relevante Daten vorliegen. Beispiel dafür sind in diesem Fall die Plasmakonzentrationen von Cabotegravir/Rilpivirin, welche Therapie-bedingt nur alle acht Wochen als Ctau, d.h. zum Zeitpunkt vor der nächsten Injektion, gemessen wurden. Ältere Modelle für orale antiretrovirale Substanzen haben beispielsweise die Messung der Plasmakonzentration über das gesamte Dosisintervall (AUC), neben Ctau, als valideste Parameter für die Arzneimittelexposition identifiziert.3 Auch in neueren Populations-kinetischen Modelle wird die AUC von Rilpivirin eingesetzt.4
Folgefehler
Folge der erstgenannten Veröffentlichung von Orkin et al. ist, dass alle Folgestudien nach denselben Kriterien ausgewertet wurden. Insbesondere die neue CARES-Studie zeigt, dass sowohl der BMI (bei richtiger Injektionstechnik) als auch das Vorliegen eines HIV-Subtyp A1 keine Rolle beim Therapieversagen gespielt haben, das vorgelegte multivariate Vorhersagemodell also zum Teil bereits widerlegt wird.5 Gleiches gilt für die kleinere Ward86-Studie.6,7
Anders
als im multivariaten Vorhersagemodell berechnet, sind die Faktoren,
die für ein Therapieversagen der LA-ART mit Cabotegravir/Rilpivirin
verantwortlich sind, nach wie vor nicht vollständig bekannt. Die
falsche Interpretation von Vorhersagemodellen führt klinisch auf
einen Irrweg. Sensitivität
und Spezifität sind entscheidende Parameter solcher Modelle, die
immer kritisch diskutiert werden müssen. Neben der Tatsache, dass
bisher für ein valides prädiktives
Modell
zu wenige klinische Daten vorliegen,
ist das in der Arbeit von Orkin und Kolleg*innen nicht gelungen.
Plasmaspiegel prädiktiv?
Plasmakonzentrationen
könnten dann eine Rolle spielen, wenn Sie als mögliche Warnsignale
verstanden werden. Bisher gibt es jedoch keine konsentierten
Grenzwerte für Plasmaspiegel bei Cabotegravir/Rilpivirin
LA
und auch keine klare Korrelation von Plasmaspiegel und
Therapieversagen.
Schweizer Empfehlung
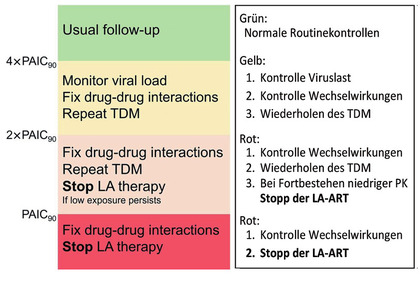
Abb. 2 Flow Chart zum Umgang mit Plasmaspiegel
Daten zu Plasmaspiegeln unter LA-ART aus der Schweizer Kohortenstudie (Swiss Cohort Study) wurden Anfang dieses Jahres publiziert. 725 Proben von insgesamt 186 Patient*innen wurden analysiert. Die Konzentrationen der untersten Quartile lagen nur knapp über den empfohlenen Ctau-Werten von Cabotegravir. Männer hatten insgesamt etwas niedrigere Cabotegravir-Plasmakonzentrationen als Frauen, während die Rilpivirin-Plasmakonzentrationen im Bereich der Zulassungsstudien lagen. Von den 11 Patient*innen mit Therapieversagen hatten wiederum drei auch niedrige Cabotegravir-Plasmakonzentrationen. Bei den anderen acht Patient*innen mit Therapieversagen fand sich kein Zusammenhang mit den gemessenen Parametern. Insgesamt gab es somit keinen statistisch signifikanten Zusammenhang von niedrigen Ctau-Werten und nachweisbarer Viruslast.9 Dennoch plädieren die Schweizer Kolleg*innen dafür, niedrige Plasmakonzentrationen zum Anlass für klinische Konsequenzen zu nehmen. Die Spiegel wurden nach bestimmten Untergrenzen der Plasma Adusted IC90(PAIC90) kategorisiert und in ein Modell eingefügt, welches den Umgang mit Plasmakonzentrationsmessungen vorschlägt (Abb. 2).8
Keine Untergrenzen
Bisher sind noch keine Konsens-fähigen Untergrenzen für die Plasmakonzentrationen von Cabotegravir/Rilpivirin im Zusammenhang mit der Injektionstherapie definiert. Vorgeschlagen wurden beispielsweise die PAIC90 in Höhe von 166 bzw. 12 ng/mL für Cabotegravir und Rilpivirin10 oder die jeweiligen 4× PAIC90, also 664 ng/mL11,12 und 50 ng/mL.13 Die französische ANRS empfiehlt darüber hinaus den Ctrough-Wert der ersten Quartile aus den Phase III-Zulassungsstudien, also 1.120 bzw. 32 ng/mL für Cabotegravir bzw. Rilpivirin.11,14 Interpretationsspielraum ist hier gegeben, insbesondere im Verhältnis der Plasmakonzentrationen zu Subtyp, BMI oder Resistenzmutationen.15
Ob die Ergebnisse der bisherigen Studien also für eine Empfehlung bezüglich Plasmakonzentrationsmessung in der klinischen Routine ausreichen, bleibt abzuwarten. Und zwar solange bis ein Zusammenhang zwischen niedrigen Pharmakonzentrationen und virologischem Versagen der Therapie wirklich gezeigt werden kann. Ohne diese Daten muss man akzeptieren, dass die hierfür notwendigen Messungen in der klinischen Routine nicht zu leisten sind.
Offene Fragen
Bis zur Klärung der prädiktiven Faktoren für ein Therapieversagen unter LA-ART einschließlich der Bedeutung der Plasmakonzentrationen bleiben viele Fragen offen:
Wie oft sollte die HIV-PCR kontrolliert werden? Alle zwei oder alle vier Monate? In den ersten 24 Wochen nach Beginn der Injektionstherapie öfter, da in dieser Zeit knapp 70% der Therapieversagen aufgetreten sind, und dann seltener7?
Wie gehen wir mit dem ersten Auftreten nachweisbarer Viruslast während einer Therapie mit Cabotegravir/Rilpivirin um? Ist es sinnvoll, in diesem Fall die Ctau zu messen und vorzugehen, wie die Schweizer vorschlagen? Oder kontrollieren – und wenn ja, in welchen Abständen? Oder die Therapie gleich absetzen?
Die Diskussion hierzu ist noch nicht abgeschlossen. Was aber fest steht ist, dass es derzeit im klinischen Alltag wenig Sinn macht, Plasmaspiegel der LA-ART mit Cabotegravir/Rilpivirin zu messen, solange sich daraus keine klare Konsequenz ergibt.
1 Orkin C, Schapiro JM, Perno CF, Kuritzkes DR, Patel P, DeMoor R, et al. Expanded Multivariable Models to Assist Patient Selection for Long-Acting Cabotegravir + Rilpivirine Treatment: Clinical Utility of a Combination of Patient, Drug Concentration, and Viral Factors Associated With Virologic Failure. Clin Infect Dis 2023; 77(10):1423-1431.
2 Cutrell AG, Schapiro JM, Perno CF, Kuritzkes DR, Quercia R, Patel P, et al. Exploring predictors of HIV-1 virologic failure to long-acting cabotegravir and rilpivirine: a multivariable analysis. AIDS 2021; 35(9):1333-1342.
3 von Hentig N, Babacan E, Staszewski S, Sturmer M, Doerr HW, Lotsch J. Predictive factors for response to a boosted dual HIV-protease inhibitor therapy with saquinavir and lopinavir in extensively pre-treated patients. Antivir Ther 2007; 12(8):1237-1246.
4 Neyens M, Crauwels HM, Perez-Ruixo JJ, Rossenu S. Population pharmacokinetics of the rilpivirine long-acting formulation after intramuscular dosing in healthy subjects and people living with HIV. J Antimicrob Chemother 2021; 76(12):3255-3262.
5 CM K. Randomized Trial of Cabotegravir and Rilpivirine Long-Acting in Africa (CARES): Week 48 Results. Converence on Retrovirals and Opportunistic Infections, Denver, USA 2024; (Poster 122).
6 Hickey MD, Grochowski J, Mayorga-Munoz F, Imbert E SJ, Oskarsson J, Shiels M, et al. 24-Week Viral Suppression in Patients Starting Long-Acting CAB/RPV Without HIV Viral Suppression. CROI, Conference on Retroviruses and Oportunistic Infections, Denver, USA 2024; (Poster‚628).
7 Gandhi M, Hickey M, Imbert E, Grochowski J, Mayorga-Munoz F, Szumowski JD, et al. Demonstration Project of Long-Acting Antiretroviral Therapy in a Diverse Population of People With HIV. Ann Intern Med 2023; 176(7):969-974.
8 Thoueille P, Cavassini M, Guidi M, Buclin T, Girardin FR, Decosterd LA, et al. Guidance for the Interpretation of Long-Acting Cabotegravir and Rilpivirine Concentrations Based on Real-World Therapeutic Drug Monitoring Data and Documented Failures. Open Forum Infect Dis 2024; 11(2):ofae023.
9 Thoueille P, Saldanha SA, Schaller F, Choong E, Munting A, Cavassini M, et al. Real-world trough concentrations and effectiveness of long-acting cabotegravir and rilpivirine: a multicenter prospective observational study in Switzerland. Lancet Reg Health Eur 2024; 36:100793.
10 Margolis DA, Gonzalez-Garcia J, Stellbrink HJ, Eron JJ, Yazdanpanah Y, Podzamczer D, et al. Long-acting intramuscular cabotegravir and rilpivirine in adults with HIV-1 infection (LATTE-2): 96-week results of a randomised, open-label, phase 2b, non-inferiority trial. Lancet 2017; 390(10101):1499-1510.
11 Orkin C, Bernal Morell E, Tan DHS, Katner H, Stellbrink HJ, Belonosova E, et al. Initiation of long-acting cabotegravir plus rilpivirine as direct-to-injection or with an oral lead-in in adults with HIV-1 infection: week 124 results of the open-label phase 3 FLAIR study. Lancet HIV 2021; 8(11):e668-e678.
12 Landovitz RJ, Li S, Eron JJ, Jr., Grinsztejn B, Dawood H, Liu AY, et al. Tail-phase safety, tolerability, and pharmacokinetics of long-acting injectable cabotegravir in HIV-uninfected adults: a secondary analysis of the HPTN 077 trial. Lancet HIV 2020; 7(7):e472-e481.
13 Aouri M, Barcelo C, Guidi M, Rotger M, Cavassini M, Hizrel C, et al. Population Pharmacokinetics and Pharmacogenetics Analysis of Rilpivirine in HIV-1-Infected Individuals. Antimicrob Agents Chemother 2017; 61(1).
14 Overton ET, Richmond G, Rizzardini G, Thalme A, Girard PM, Wong A, et al. Long-Acting Cabotegravir and Rilpivirine Dosed Every 2 Months in Adults With Human Immunodeficiency Virus 1 Type 1 Infection: 152-Week Results From ATLAS-2M, a Randomized, Open-Label, Phase 3b, Noninferiority Study. Clin Infect Dis 2023; 76(9):1646-1654.
15 D’Antoni ML, Falkard B, Andreatta K, Cox S, Cohen C, C. C. Assessing Phenotypic Effect of Integrase Strand Transfer Inhibitor (INSTI)-Based Resistance Substitutions Linked to Failures on Cabotegravir. EACS 2023 Warsaw,Poland 2023; October 18-21(Poster eP.B1.021).









 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen