Arzneimittelpreise im Spannungsfeld
Der Arzneimittelmarkt ist geprägt vom Anspruch auf wirksame und sichere Arzneimittel für alle Menschen weltweit und dem Anspruch auf Gewinn für die Unternehmen und deren Aktien-Besitzer. In diesem Spannungsfeld bewegen sich die Arzneimittelpreise. In Deutschland haben die Bemühungen, die Arzneimittelpreise möglichst niedrig zu halten zu Versorgungsengpässen bei Generika und fehlender Verfügbarkeit von Innovationen geführt – auch im HIV-Bereich. HIV&more sprach mit dem Markt-Experten von Gilead Sciences Dr. Robert Welte über die Hintergünde und Probleme.
Interview
mit Dr. Robert Welte, Gilead Sciences
Unser
Ziel: Lenacapavir zur Prophylaxe weltweit verfügbar machen!
 Dr. Robert Welte
Dr. Robert Welte
Senior Director,
Market Access &
Reimbursement
Gilead Sciences
Martinsried
 Arne Neumeyer
Arne Neumeyer
Director,
Public Affairs
Gilead Sciences
Martinsried
© Gilead Sciences
Seit einigen Jahren gibt es immer mehr relevante Arzneimittelengpässe in Deutschland. Woran liegt das?
Welte: Eine übermäßige Ökonomisierung im Bereich der Versorgung kann dazu führen, dass der günstigste Preis Produktion und Verfügbarkeit steuert und nicht der tatsächliche Bedarf das Angebot bestimmt. Bei vielen generischen Produkten wurde die Kostenschraube in Deutschland vor allem durch zwingende Ausschreibungen und Festbeträge so weit gedreht, dass sich die Produktion von bestimmten Arzneimitteln in Europa nicht mehr abbilden lässt – rund 68 Prozent der Produktionsstandorte von bestimmten Wirkstoffen für Europa liegen mittlerweile in Asien.1
Die Europäische Arzneimittelagentur (EMA) hat sich die Zahl der Arzneimittellieferengpässe für den Zeitraum 2000 und 2018 angeschaut und festgestellt, dass sie sich insgesamt um das 20-fache bzw. allein seit 2008 um das 12-fache erhöht hat.2 Das sei in erster Linie auf zunehmende Konzentration und anfällige Lieferketten zurückzuführen, die mit einer begrenzten Anzahl von Chemikalienherstellern, vorwiegend in China, verbunden sind.2
In Deutschland ansässige Pharmaunternehmen scheinen ihre Lieferketten für Vorleistungen bzw. Hilfsstoffe recht resilient halten zu können, wie sich während der Corona-Pandemie zeigte: Die Versorgung mit hier produzierten Arzneimitteln für die Bevölkerung konnte gewährleistet werden.3 Wenn aber Indien, einer der weltweit größten Produzenten und Exporteure von Arzneimitteln, ein – wie im März 2020 geschehen – Ausfuhrverbot von 26 Arzneimitteln, vorrangig Antibiotika und Arzneimittelbestandteile, verhängt, fehlen die natürlich den Patientinnen und Patienten in Deutschland. Indiens Pharmaunternehmen beziehen etwa 70 Prozent ihrer Inhaltsstoffe aus chinesischen Fabriken, von denen viele aufgrund des Coronavirus-Ausbruchs über Wochen geschlossen waren. Die Schließung von Flughäfen in China behinderte zusätzlich auch die Lieferungen nach Indien.4
Es kann allerdings nicht das Ziel sein, eine nationale Autarkie zu schaffen. Das wäre unrealistisch und will auch niemand. Vielmehr wäre eine globale Verteilung der benötigten Produktionen anzustreben. Damit könnten einseitige Abhängigkeiten auf den einzelnen Stufen der pharmazeutischen Lieferketten verringert werden.
Um aber auf die Produktion von Generika und bestimmten Arzneimitteln zurückzukommen, die aktuell von Lieferengpässen betroffen sind: Solange sich in unserem Gesundheitssystem Krankenkassen auf den niedrigsten Preis fokussieren müssen, werden europäische Produkte nicht wettbewerbsfähiger werden.
Seit Ende letzten Jahres gibt es das Arzneimittelengpassbekämpfungsgesetz. Was besagt dieses Gesetz? Und hat es geholfen?
Welte:Das Arzneimittel-Lieferengpassbekämpfungs- und Versorgungsverbesserungsgesetz – kurz ALBVVG – wurde vom Bundesministerium für Gesundheit am 26. Juni 2023 veröffentlich.5 Sein Ziel ist es, die Versorgungssicherheit mit Arzneimitteln kurz- und langfristig zu stärken. Dazu sind strukturelle Maßnahmen im Bereich der Festbeträge, Rabattverträge sowie der Medikamentenproduktion vorgesehen. Ein besonderer Schwerpunkt liegt auf der Verfügbarkeit von Kinderarzneimitteln. Der Wunsch, der dahintersteht, ist, Deutschland als Absatzmarkt wieder attraktiver für generische Arzneimittel zu machen und europäische Produktionsstandorte zu stärken. Außerdem sollen Kontroll- und Reaktionsmechanismen verbessert werden.
Aus dem Katalog der Maßnahmen sind einige hervorzuheben: Das Gesetz sieht eine Verpflichtung der Unternehmen vor, Lagerbestände für rabattierte patentfreie Arzneimittel vorzuhalten und ein Frühwarnsystem für Lieferengpässe zu etablieren. Krankenkassen sind verpflichtet, auch patentfreie Antibiotika, die in der Europäischen Union oder dem europäischen Wirtschaftsraum produziert werden, einzukaufen. Für versorgungskritische Arzneimittel sollen die Festbeträge angehoben werden, um deren Produktion auch für hiesige Hersteller attraktiver zu machen. Für Kinderarzneimittel werden die Festbeträge aufgehoben und die Rabattverträge abgeschafft.
Bei Pädiatrischen und Onkologischen Arzneimitteln sowie bei Antibiotika sprechen wir allerdings nur über einen Teil versorgungskritischer Arzneimittel. Wirkstoffe für Menschen mit chronischen Erkrankungen, die ebenso notwendig auf eine verlässliche Versorgung vertrauen können müssen, sind im ALBVVG bisher nicht ausreichend berücksichtigt. Wir haben gerade Anfang 2024 einen Engpass bei generischem Emtricitabin/Tenofovirdisoproxil für die Behandlung von Menschen mit HIV bzw. als Präexpositionsprophylaxe gesehen.
Prinzipiell scheinen die Maßnahmen des ALBVVG sinnvoll, doch aktuelle Daten, in welchem Umfang das Gesetz jetzt schon Wirkung zeigt, musste die Bundesregierung nach einer Kleinen Anfrage der Fraktion der CDU/CSU vom 8. August 2024 in ihrer Antwort vom 2. September 2024 noch schuldig bleiben.6,7
Auch im Markt mit Originalpräparaten sieht es in Deutschland nicht gut aus. Einige Hersteller haben ihre Medikamente zurückgezogen oder erst gar nicht in den Verkauf gebracht. Ein Bespiel ist hier Lenacapavir, das in vielen Ländern Europas sowie in Japan und den USA erhältlich ist, aber nicht in Deutschland. Warum?
Welte:Grundsätzlich hat sich das Arzneimittelmarktneuordnungsgesetz (AMNOG) bewährt und ist international so anerkannt, dass sich viele Länder an seinen Ergebnissen orientieren. Das AMNOG kann also als ein Markenzeichen des deutschen Pharmastandorts verstanden werden. Wie jede Regelung funktioniert es zwar für einen Großteil der zugelassenen Arzneimittelklassen, aber leider nicht für alle. Für diese Ausnahmen ist Spielraum notwendig, welcher durch das GKV-Finanzstabilisierungsgesetz (z.B. durch Leitplanken für Preisverhandlungen und den Kombi-Rabatt) stark eingeschränkt wurde. Dies hat zu Marktrücknahmen und dem Nicht-Inverkehrbringen von Arzneimitteln geführt. Zudem hat sich die Welt weitergedreht, sodass auch neue Herausforderungen in der Versorgung entstanden sind, weswegen bestimmte AMNOG-Regelungen an die aktuellen und zukünftigen Anforderungen angepasst werden sollten (z.B. akzeptierte Studienendpunkte, indirekte Vergleiche, Korrektur für Cross-Over in Studien etc.).
Lenacapavir ist ein Beispiel für ein Arzneimittel, welches trotz Zulassung durch die Europäische Kommission in Deutschland nicht in den Markt gebracht wurde. Um zu verstehen, worin die Problematik beim Durchlaufen eines AMNOG-Prozesses bei diesem Wirkstoff liegen würde, sei hier noch einmal der Zulassungstext genannt: Lenacapavir ist in Kombination mit anderen antiretroviralen Arzneimitteln zur Behandlung von Erwachsenen mit einer multiresistenten HIV-1-Infektion indiziert, bei denen kein anderes supprimierendes, antivirales Regime zusammengestellt werden kann.8
Das Arzneimittel wirkt also bei Patienten mit multiresistenter HIV-Infektion, bei denen andere Therapieoptionen ausgeschöpft sind. Lenacapavir stellt für intensiv vorbehandelte HIV-Patienten (HTE) eine Sprunginnovation dar.
Die Entscheidung, Lenacapavir in Deutschland nicht einzuführen, beruht auf der Tatsache, dass sich der große klinische Nutzen, den Lenacapavir für die Patienten bietet, höchstwahrscheinlich nicht in einer entsprechenden Bewertung im AMNOG-Verfahren niederschlagen würde: In Bezug auf die im AMNOG angewandten formalmethodischen Kriterien stellt die Durchführung von nutzenbewertungsrelevanten klinischen Studien bei vorbehandelten Patienten mit multiresistenter HIV-Infektion per se eine große Herausforderung dar. Ebenso wie auch die früheren Studien in dieser Population, erfüllt auch die CAPELLA-Zulassungsstudie für Lenacapavir nicht die formalmethodischen Anforderungen der Nutzenbewertung.
Die
Anforderungen, die die Zulassungsbehörden EMA und FDA (Food and Drug
Administration) an ein Studiendesign stellen, unterscheiden sich von
den Anforderungen, die für eine Nutzenbewertung im deutschen
AMNOG-System vorgesehen sind. Im Fall der HIV HTE-Population
schließen sich die Vorgaben teilweise aus – z.B. hinsichtlich der
vergleichenden Studienphase: Der G-BA fordert eine Mindestdauer von
24 Wochen, die Zulassungsbehörden dagegen 1-2 Wochen (FDA). Die
Zulassungsbehörden begründen ihr Vorgehen mit dem Resistenzproblem:
Wenn Patienten mit multiresistenter HIV-1 Infektion über längere
Zeit eine funktionelle Monotherapie (in Kombination mit der
bestehenden Therapie) erhalten, steigt die Wahrscheinlichkeit, dass
sich gegenüber dem neuen Arzneimittel Resistenzen bilden oder
gegenüber den nicht mehr wirksamen Arzneimitteln noch weitere
Resistenzen entwickeln.9
Für Lenacapavir ließe sich zusammenfassen, dass das AMNOG-System strukturell nicht geeignet ist, eine Studie wie die CAPELLA-Studie zu Lenacapavir überhaupt zu bewerten: Messsystem und Messgut sind nicht in Übereinstimmung zu bringen. Gilead hat hier unter Berücksichtigung der geringen Patientenzahl die entsprechende Entscheidung der Nicht-Einführung getroffen.
Gilead arbeitet an einer patientenorientierten Lösung. Die Situation ist vergleichbar mit jener von Reserveantibiotika – dort hat der Gesetzgeber bereits reagiert: Reserveantibiotika können einen Zusatznutzen erhalten, ohne dass dieser in einem AMNOG-Verfahren belegt werden muss.10
Lenacapavir ist nicht nur gegen resistente HI-Viren wirksam, sondern als Prüfpräparat auch hochwirksam zur HIV-PrEP. Das sind zwei unterschiedliche Indikationen. Kann man hier auch einen unterschiedlichen Preis gestalten?
Welte: Prinzipiell ist dies möglich, sofern die EMA für jede der beiden Anwendungen eine eigenständige Zulassung erteilt. Wir gehen davon aus, dass sich der Preis für Lenacapavir in der Präexpositionsprophylaxe (PrEP) in diesem Fall signifikant von dem Preis in der HTE-Zulassung unterscheiden würde.
Gleich nach Vorstellung der Ergebnisse der PURPOSE 1-Studie kam die Forderung zum raschen und weltweiten Zugang zur Lenacapavir-PrEP. Wie hat Gilead darauf reagiert?
Welte: Aktuell gibt es in keinem Land der Welt eine Zulassung von Lenacapavir zur PrEP. Die zwei entscheidenden Phase-3-Studien zu Lenacapavir für die PrEP, PURPOSE 1 und PURPOSE 2, wurden Anfang dieses Jahres vorzeitig entblindet, da sie ihre wichtigsten Wirksamkeitsendpunkte hinsichtlich der Überlegenheit von zweimal jährlich verabreichtem Lenacapavir gegenüber einmal täglich oral verabreichtem Emtricitabin/Tenofovirdisoproxil und der Hintergrund-HIV-Inzidenz erreichten.11 Natürlich sind wir bestrebt, den Antrag zur Zulassung des Präparats so schnell wie möglich einzureichen.
Gilead hat hier einen radikalen Schritt zur Versorgung der Länder mit dem höchsten medizinischen Bedarf unternommen: Gilead hat bereits jetzt mit sechs Pharmaherstellern (1 in Ägypten, 3 in Indien, 1 in Pakistan, 1 in USA) nicht-exklusive, gebührenfreie und freiwillige Lizenzvereinbarungen zur Herstellung und zum Vertrieb von generischem Lenacapavir in 120 Ländern mit hoher Inzidenz und begrenzten Ressourcen unterzeichnet.11 Es handelt sich hauptsächlich um Länder mit niedrigem und mittlerem Einkommen, die aber global die höchsten Raten an HIV-Infektionen aufweisen. Die Vereinbarungen wurden vor der Einreichung von Zulassungsanträgen bei den globalen Regulierungsbehörden unterzeichnet, um es diesen Ländern zu ermöglichen, im Falle einer Zulassung schnell hochwertige und kostengünstige Versionen von Lenacapavir zur HIV-Prävention einzuführen.
Wird die Lenacapavir-PrEP weltweit gleichzeitig zugelassen werden?
Lieferketten für Vorleistungen bzw. Hilfsstoffe
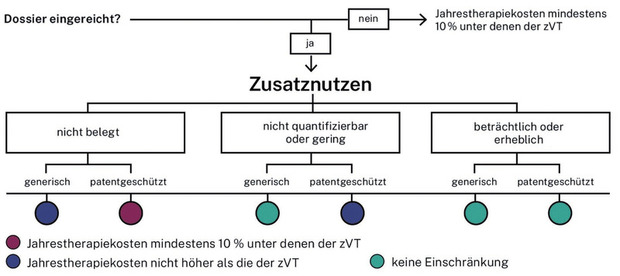
Fortan werden Kostenobergrenzen für bewertete Arzneimittel in Abhängigkeit des festgestellten Zusatznutzens sowie des Patentstatus der zweckmäßigen Vergleichstherapie (zVT) festgelegt. Lediglich für Arzneimittel mit beträchtlichem oder erheblichem Zusatznutzen gelten dabei keinerlei Einschränkungen. Ab Januar 2025 sollen Anpassungen nach dem Medizinforschungsgesetz (MFG) greifen.
 © Verband der Ersatzkassen
© Verband der Ersatzkassen
Welte: Unser Ziel ist es, unsere Arzneimittel nach Abschluss der notwendigen Studien schnellstmöglich in den verschiedenen Regionen und Ländern in den Verkehr zu bringen. Aufgrund von unterschiedlichen Anforderungen dauert dies unterschiedlich lange. Derzeit gehen wir davon aus, dass wir zuerst die Zulassung in den USA erhalten werden, anschließend in Europa, inklusive Deutschland. Der Antrag für Lenacapavir für die Präexpositionsprophylaxe soll noch dieses Jahr eingereicht werden.
Gilead plant, das Produkt ohne Gewinn für das Unternehmen zu bepreisen. Wie kann man sich das vorstellen? Laut einer Studie, die parallel zur Vorstellung der Daten zur Lenacapavir-PrEP auf dem WeltAidsKongress vorgestellt wurde, belaufen sich die Herstellungskosten pro Person für ein Jahr Lenacapavir-PrEP auf 100 U$.
Welte: Die Vereinbarungen zur Herstellung von hochwertigen generischen Versionen unterstützen die Strategie von Gilead, im Falle einer Zulassung einen breiten, nachhaltigen Zugang zu Lenacapavir für die Präexpositionsprophylaxe weltweit zu ermöglichen, und stehen im Einklang mit Gileads Vision, die HIV-Epidemie für alle Menschen überall auf der Welt zu beenden. Daher plant Gilead bis zu dem Zeitpunkt, zu welchem generisches Lenacapavir in den oben genannten 120 Ländern zur Verfügung steht, das Arzneimittel diesen Ländern zum Selbstkostenpreis zur Verfügung zu stellen.11,12
Aufgrund des besonders hohen medizinischen Bedarfs wird Gilead zudem die Zulassung für 18 Länder priorisieren, die ca. 70% der HIV-Krankheitslast der oben genannten 120 Länder ausmachen. Diese Länder sind Botswana, Swasiland, Äthiopien, Kenia, Lesotho, Malawi, Mosambik, Namibia, Nigeria, Philippinen, Ruanda, Südafrika, Tansania, Thailand, Uganda, Vietnam, Sambia und Simbabwe.
In reichen Ländern wie Deutschland wird Lenacapavir vermutlich wesentlich teurer sein als beispielsweise in Afrika…
Welte: Wir sind bestrebt, die Entwicklungskosten fair auf die unterschiedlich starken Schultern der Länder zu verteilen, wie dies von der Weltbank und der WHO auch gefordert wird.13 Somit muss der Preis in wirtschaftlich stärkeren Ländern wie Deutschland höher sein als in Ländern mit einem geringeren pro Kopf Bruttoinlandsprodukt.
Interviewpartner:
Dr.
Robert Welte
Senior
Director, Market Access &
Reimbursement
E-Mail:
robert.welte@gilead.com
Arne
Neumeyer
Director,
Public Affairs
Gilead
Sciences GmbH
Fraunhoferstr.
17 · 82152 Martinsried
E-Mail:
arne.neumeyer@gilead.com
1 https://www.vfa.de/de/presse/pressemitteilungen/pm-012-2022-neue-strategie-fuer-pharmazeutische-lieferketten-notwendig.html
2 https://www.europarl.europa.eu/doceo/document/A-9-2020-0142_EN.pdf
3 https://www.vfa.de/download/studie-resilienz-pharmazeutischer-lieferketten.pdf
4 https://www.theguardian.com/world/2020/mar/04/india-limits-medicine-exports-coronavirus-paracetamol-antibiotics
5 https://www.bundesgesundheitsministerium.de/ministerium/gesetze-und-verordnungen/guv-20-lp/albvvg.html
6 https://dserver.bundestag.de/btd/20/125/2012581.pdf
7 https://dserver.bundestag.de/btd/20/127/2012756.pdf
8 https://www.ema.europa.eu/en/documents/product-information/sunlenca-epar-product-information_en.pdf
9 https://www.fda.gov/regulatory-information/search-fda-guidance-documents/human-immunodeficiency-virus-1-infection-developing-antiretroviral-drugs-treatment
10 https://www.gesetze-im-internet.de/sgb_5/__35a.html
11 https://www.gilead.com/news/news-details/2024/gilead-signs-royalty-free-voluntary-licensing-agreements-with-six-generic-manufacturers-to-increase-access-to-lenacapavir-for-hiv-prevention-in-high-incidence-resource-limited-countries
12 https://www.nytimes.com/2024/10/02/health/lenacapavir-hiv-shot-prep.html
13 https://documents1.worldbank.org/curated/en/108331467986267584/pdf/99587-WP-P127759-Box393202B-PUBLIC-Cost-Effectiveness-Toolkit-FINAL.pdf









 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen