Tobias Glausinger, Berlin
Mycoplasma genitalium Resistenz
Screening? Besser nicht
Ureaplasmen sind sehr häufige Kommensalen in der Vaginalmukosa der Frau. In einer eigenen Untersuchung waren bei mehr als 80% aller asymptomatischen Frauen Ureaplasmen im Vaginalabstrich nachweisbar. Hierbei kommt U. parvum ungleich häufiger vor als U. urealyticum. Die beiden Biovare sind zudem nur mittels PCR, nicht jedoch mittels kultureller Verfahren differenzierbar. Ob und wie häufig eine urethritische Symptomatik bei Frauen durch Ureaplasmen ausgelöst werden kann, ist nicht abschließend geklärt. Unstrittig ist ein pathogenetisches Potenzial der Ureaplasmen für Schwangerschaftskomplikationen wie Frühgeburtlichkeit und schwere Infektionen bei sehr unreifen Neugeborenen. Generell gilt jedoch, dass der Nachweis von Ureaplasmen bei nicht-schwangeren Frauen einer Besiedlung und nicht einer Infektion entspricht. Eine antibiotische Therapie dieser Keime ist bei Frauen außerhalb einer Schwangerschaft deshalb nicht indiziert.
Ein Experten-Statement der IUSTI (International Union Against Sexually Transmitted Infection) spricht sich klar gegen eine Testung auf Ureaplasmen und Mycoplasma hominis im Rahmen von STI-Tests aus. Auch sollten Screenings auf Mycoplasma genitalium unterbleiben. Eine spezifische Differentialdiagnostik sollte nur bei passenden klinischen Krankheitsbildern, insbesondere bei der Urethritis des Mannes erfolgen. Wenn eine Testung erfolgen soll, ist jedoch nur die Testung mit einem NAAT zielführend, da beispielsweise Mycoplasma genitalium de facto nicht in einem Routinelabor kultivierbar ist.
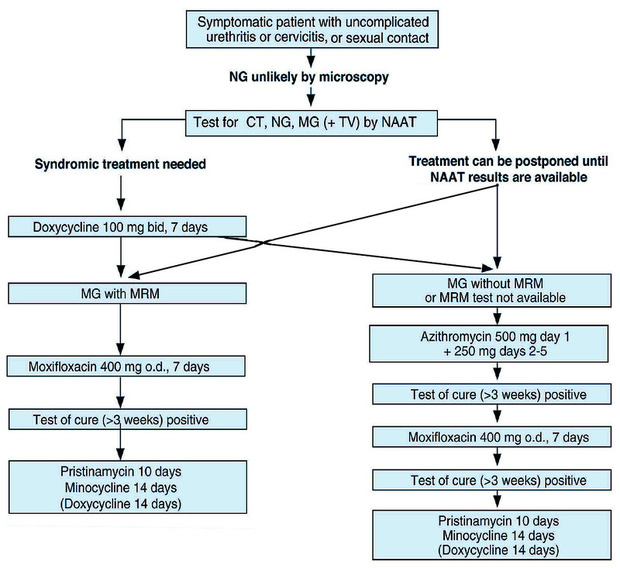
2021 European guideline on the management of Mycoplasma genitalium infections
Makrolid-Resistenz
Die antibiotische Behandlung von Infektionen mit Mycoplasma genitalium ist überaus herausfordernd. Auf die Zellwandsynthese oder -struktur einwirkende Pharmaka sind aufgrund des Fehlens einer solchen nicht wirksam. Antiinfektiva, die auf die Proteinbiosynthese oder den Nukleinsäurestoffwechsel der Bakterien inhibitorisch wirken, sind potenziell effektiv. Jedoch kommt es durch den Selektionsdruck der Antibiotika schnell zu genetischen Veränderungen im Bakteriengenom und folglich zur Selektion resistenter Stämme.
Kurzportrait Mycoplasmen/Ureaplasmen
Mycoplasma genitalium ist neben Mycoplasma pneumoniae der klinisch wichtigste humanpathogene Vertreter der Familie Mycoplasmataceae. Allen Myco- und Ureaplasmen gemein ist, dass sie nur eine Zellmembran, aber keine Zellwand besitzen. Hieraus leitet sich der Name der Art „Mollicutes“ – „Weichhäutige“ ab. Mollicutes sind die kleinsten selbständig lebenden, sich selbst vermehrenden Lebensformen mit dem kleinsten Genom aller bekannten Bakterien. Hieraus leiten sich typische Charakteristika der Erreger ab: Die fehlende Zellwand macht sie intrinsisch resistent gegen alle Antibiotika, die auf die Zellwandsynthese einwirken. Das kleine Genom minimiert ihre Ausstattung mit Enzymen und anderen Genprodukten, was ihr Stoffwechselrepertoire stark limitiert. In der Folge sind sie auf zahlreiche, für ihren eigenen Stoffwechsel elementar nötige Substrate wie Nuklein- und Fettsäuren, Vitamine und Purine/Pyrimidine aus der Umgebung angewiesen, was sie zu häufigen, parasitär lebenden Kommensalen auf Schleimhäuten und Zellkulturen macht.
Mycoplasma
genitalium
(MG) ist innerhalb der Erregergruppe der wichtigste Auslöser sexuell
übertragener, urogenitaler
Infektionen. Seine Fähigkeit, bei
Männern eine Urethritis auszulösen ist ebenso unstrittig wie sein
Potenzial, bei Frauen eine Cervicitis, Urethritis und eine Pelvic
Inflammatory Disease zu verursachen. Nicht eindeutig geklärt ist, ob
und wie häufig eine Proktitis
durch den Erreger ausgelöst wird. Mycoplasma hominis
hat ein nur sehr geringes pathogenes Potential und ist lediglich
sporadisch mit eher opportunistischen Infektionen, Schwangerschafts-
und Neugeborenen-Komplikationen assoziiert.
Ureaplasma urealyticum kann – im Gegensatz zu Ureaplasma parvum – Auslöser einer Urethritis beim Mann sein. Einige Untersuchungen legen eine Assoziation von U. urealyticum mit dem Auftreten einer Prostatitis oder Epidydimitis sowie einer männlichen Infertilität nah. Unstrittig gesicherte diesbezügliche Kausalitäten gibt es jedoch nicht. In der Mehrzahl der Fälle ist ein Nachweis des Erregers bei Männern nicht mit klinischen Beschwerden assoziiert. In diesen Fällen ist der Keim als Besiedler und nicht als Erreger anzusehen. Eine antibiotische Behandlung ist dann nicht erforderlich.
Therapeutisch am besten untersucht ist die Behandlung von MG mit Azithromycin. Dieses ist bei suszeptiblen Stämmen sehr gut wirksam. Leider kam es in den letzten Jahren – parallel zu dessen zu breitem Einsatz auch beim Management von STI – zunehmend zu Antibiotika-induzierten Resistenzentwicklungen. Die Folge ist der – insbesondere bei MSM – weitgehende Ausfall von Makroliden als Therapieoption. Insbesondere die Einmalgabe von Azithromycin geht mit einem mehr als 10-prozentigen Risiko einer therapieinduzierten Resistenz gegen Makrolide einher. Diese Selektion resistenter Stämme kann durch eine über mehrere Tage gestreckte Gabe von Azithromycin deutlich gesenkt werden.
Korrelate einer Makrolid-Resistenz sind gut definierte Mutationen an der Position 2058 und 2059 im 23S rRNA-Gen. Diese können durch Sequenzierung des Gens oder mittels mutationsspezifischer PCRs sehr zuverlässig nachgewiesen werden. Zur Bestimmung der Makrolid-Resistenz sind kommerziell erhältliche und zugelassene PCR-Tests in einigen deutschen Einsendelabors verfügbar. Einige Zentren verfügen zudem über Point of Care PCR-Systeme, die in einer Untersuchung sowohl die Detektion von Mycoplasma genitalium als auch den Nachweis von Makrolid-Resistenzmutationen ermöglichen.
Chinolon-Resistenz
Moxifloxacin galt lange als das second line-Antibiotikum beim Vorliegen von Makrolid-Resistenz. Jedoch werden in den letzten Jahren auch zunehmend Chinolon-Resistenzen nachgewiesen. Als Korrelat einer solchen gelten Veränderungen im parC- und gyrA-Gen der Topoisomerase IV. Im Gegensatz zu den gut mit einer Resistenz korrelierten Makrolid-Mutationen ist die Assoziation mit den parC-/gyrA-Mutationen nicht immer ganz eindeutig. Auch für die genotypische Testung auf Chinolon-Resistenz gibt es kommerzielle PCR-Tests.
Tetrazyklin-Resistenz
Doxycyclin führt bei einer Mycoplasma genitalium-Infektion nahezu immer zu einer deutlichen Reduktion der Bakterienlast – und damit einhergehend meist zu einer Besserung der Symptome – jedoch nur in 30-40% zu einer Eradikation der Erreger. Eine alleinige Doxycyclin-Gabe ist also therapeutisch oft unzureichend. Vorwiegend durch Arbeiten des Melbourne Sexual Health Center vorangetrieben, hat sich in den letzten Jahren zunehmend das Konzept der resistenz-gesteuerten sequentiellen Therapie etabliert. Hierbei wird die Behandlung mit Doxycyclin begonnen. Zuvor wird eine Probe zur Resistenztestung gewonnen und diese veranlasst. Liegt dann – zumeist innerhalb einer Woche nach Therapiebeginn – das Ergebnis der Resistenztestung vor, wird die Behandlung mit dem dabei als wirksam gefundenen Antibiotikum vervollständigt. Wenn keine Makrolid-Resistenzen vorliegen, folgen auf sieben Tage Doxycyclin vier bis fünf Tage Azithromycin. Beim Vorliegen von Makrolid-Resistenz folgen sieben bis zehn Tage Moxifloxacin.
Doppelt resistent
Problematisch
sind die immer öfter vorliegenden – aber nur in wenigen deutschen
Labors getesteten – Chinolon-resistenten Stämme, die zumeist auch
gegen Makrolide resistent sind. Hier galt in der Vergangenheit das
nur in Frankreich erhältliche Pristinamycin (teuer, nur über die
internationale Apotheke beziehbar) als Hoffnungsträger. Seit 2022
ist jedoch dieses kaum noch verfügbar. In einer solchen Situation
kann eine längere Gabe von Doxycyclin oder die Gabe von Minocyclin
erfolgreich sein. Minocyclin ist zwar ebenso wie Doxycyclin ein
Tetrazyklin, hat sich aber in Laborstudien jedoch als wirksamer als
Doxycyclin erwiesen. Eine erneut aus dem Zentrum in Melbourne
stammende
Pilotstudie hat überraschend gute Eradikationsraten
von über 70% nach 14-tägiger Gabe von Minocyclin gegen
doppelt-resistente MG gezeigt.
Daten aus Berlin
Als eine auf die Behandlung von STI spezialisierte Berliner Praxis testen wir seit etwa zehn Jahren auch auf MG. Aufgeschreckt durch die Meldungen hoher Makrolid-Resistenzraten insbesondere bei MSM haben wir 2017 Kontakt zu Dr. Roger Dumke vom Konsilarlabor für Mykoplasmen an der Uniklinik Dresden aufgenommen. Hieraus entstand die Idee für eine klinische Langzeit-Studie, deren Ergebnisse wir auf dem Deutschen STI-Kongress im August 2024 in Bielefeld präsentiert haben. Die wichtigsten Erkenntnisse dieser Untersuchung möchte ich hier vorstellen.
Methodik
Im Zeitraum August 2017 bis Juli 2024 wurden nahezu alle in der Praxis diagnostizierten Fälle von MG-Infektionen einer Resistenztestung zugeführt. Hierbei wurden Mutationen im 23S rRNA- und gyrA-Gen der Erreger entweder mittels Sanger-Sequenzierung im Konsilarlabor der Uniklinik Dresden oder/und mittels mutationsspezifischer PCRs in zwei Berliner Einsendelabors bzw. im Praxislabor mittels einer POC-PCR nachgewiesen. Nicht immer gelang eine Resistenztestung. In vielen Fällen lagen zu einer Probe parallele Befunde aus Testungen mittels Sequenzierung und mutationsspezifischer PCR vor. Sollten hierbei divergente Befunde erhoben worden sein, so wurde der Befund der Sequenzierung als maßgeblich angesehen. In einigen Fällen ließen sich die Makrolid- und die Chinolon-Resistenzen jeweils nur in einem Verfahren nachweisen. Hierbei sind dann „hybride“ Befunde aus zwei Verfahren entstanden.
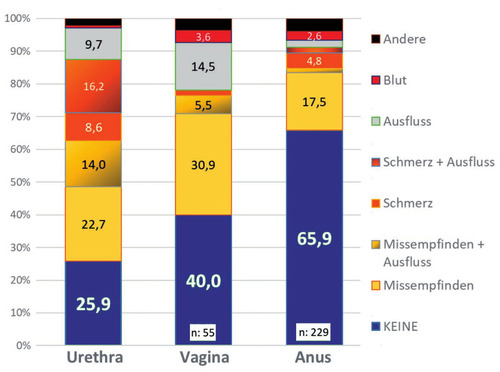
Abb. 1 MG-Nachweis nach Klinik und Lokalisation
Zu allen Fällen wurden zudem strukturierte klinische Daten zu Symptomen und Testanlass, zur Art sexueller Kontakte (gleich-, gegengeschlechtlich, bisexuell) sowie Daten zur Therapie und zum Therapieansprechen erfasst. Der Therapieerfolg wurde in der Auswertung nur berücksichtigt, wenn im Zeitraum von 14 bis 90 Tagen nach Ende der Antibiotikaeinnahme ein Test of Cure durchgeführt wurde. Die Studie wurde von der Ethikkommission der Uniklinik Dresden genehmigt und die Patient*innen haben eine schriftliche Einwilligung zur Auswertung ihrer Daten unterschrieben.
Ergebnisse
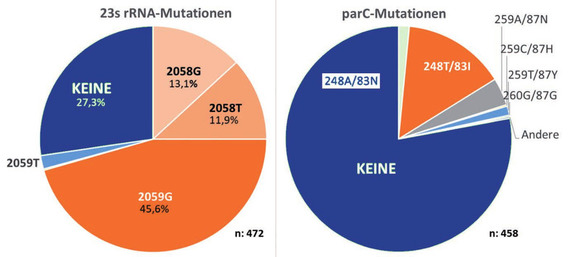
Abb. 2 Links: Makrolid-Resistenz; rechts: Chinolon-Resistenz
Im Zeitraum von sieben Jahren wurden 398 Männer, die (auch) Sex mit Männern haben (MSM), 86 Männer, die Sex nur mit Frauen haben (MSW) und 62 Frauen mit einer Mycoplasma genitalium-Infektion untersucht.
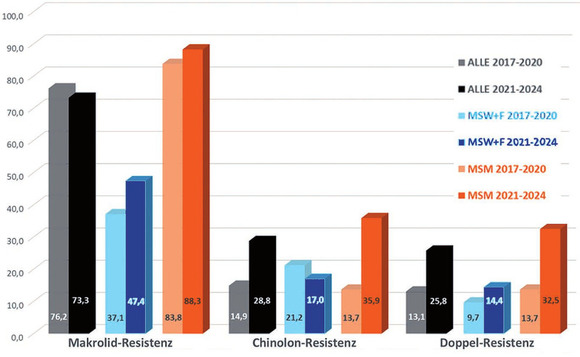
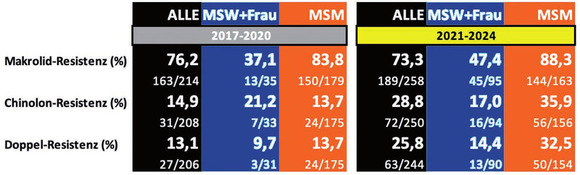
Abb. 3 Resistenzraten im zeitlichen Verlauf 2017-2020 vs 2021-2024 und nach Patientengruppen
Bezüglich der klinischen Symptomatik fanden sich deutliche Unterschiede je nach Lokalisation des MG-Nachweises: MG-Nachweise aus der Urethra von Männern waren in 3/4 der Fälle von Symptomen begleitet. Vaginale Nachweise bei Frauen waren in 60% symptomatisch. Nachweise von MG im Anus waren hingegen nur in etwa einem Drittel der Fälle symptomatisch (Abb. 1).
Genotypische Befunde zur Resistenz gegen Makrolide (23S rRNA) konnten in 472 Fällen erhoben werden. Mit einer Chinolon-Resistenz assoziierte Resistenzmutationen im parC-Gen ließen sich in 458 Fällen nachweisen (Abb. 2).
In 72,7% aller untersuchten Isolate lag eine Makrolid-Resistenz vor. Die Mutation 2059G war mit 45,6% die häufigste resistenzvermittelnde Mutation in der 23S rRNA.
Eine
Chinolon-Resistenz fand sich in 22,1% aller Isolate. Die Mutation
248T (83I) stellte die häufigste zu einer
Chinolon-Resistenz
führende Mutation dar.
Resistenzentwicklung
Es fanden sich deutliche Unterschiede zwischen verschiedenen Patientengruppen in Bezug auf die Häufigkeit und die zeitliche Zunahme von Resistenzen im Verlauf der Untersuchung (Abb. 3). So waren bei Männern, die Sex mit Männern haben (MSM) in den ersten dreieinhalb Jahren der Studie bereits in 83,8% der Fälle Azithromycin-resistente Stämme nachweisbar. Der initial bereits sehr hohe Anteil resistenter Stämme stieg im Verlauf der Untersuchung bei MSM nur gering an (88,3%).
Bei rein heterosexuellen Männern (MSW) und bei Frauen fanden sich in der ersten Hälfte des Studienzeitraums mit 37,1% weniger als halb so viele Makrolid-Resistenzen. Die dennoch für uns erstaunlich hohen Raten stiegen in der zweiten Hälfte der Untersuchung auf fast die Hälfte der Fälle (47,4%) an.
Chinolon-Resistenzen fanden sich ebenfalls häufiger bei MSM: In der ersten Studienhälfte in 13,7%, in der zweiten Studienhälfte fast dreimal soviel (35,9%). Hingegen war der Anteil bei rein heterosexuellen Männern (MSW) und bei Frauen unter Berücksichtigung der niedrigeren Fallzahlen nahezu konstant (21,2% vs. 17,0%).
Die „Problemfälle“ doppelt resistenter, also gegen Makrolide und Chinolone resistenter Isolate, fanden sich demzufolge auch häufiger bei MSM als bei MSW und Frauen. Bei MSM stiegen diese von 13,7% in der ersten Studienhälfte auf 32,5% in der zweiten Studienhälfte auf fast das dreifache an. Bei MSW und Frauen war der Anstieg von 9,7% auf 14,4% unter Berücksichtigung niedrigerer Fallzahlen nur minimal.
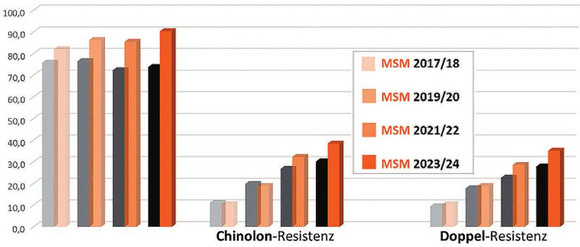
Abb. 4 Resistenzentwicklung MG-Isolate im zeitlichen Verlauf in %
Die MSM stellten also die Gruppe mit den höchsten Resistenzraten dar. Gleichzeitig kam es im zeitlichen Verlauf zu einer kontinuierlichen Zunahme der Makrolid- und Chinolon-Resistenzen in dieser Gruppe (Abb. 4).
Doppelt resistent
Ein zunehmendes Problem stellten „doppelt resistente“ MG-Stämme dar, die weder mit Azithromycin noch mit Moxifloxacin gut behandelbar waren. Im Laufe der sieben Jahre, in der die Untersuchung lief, änderte sich unsere Strategie der Behandlung dieser „Problemfälle“ etwas. Anfangs versuchten wir eine verlängerte Gabe von Doxycyclin (14 bis 21 Tage), später den häufigeren Einsatz von Pristinamycin. Mit zunehmenden Berichten über das Konzept der resistenzgesteuerten sequenziellen Therapie gingen wir zunehmend zu einer zweiphasigen Behandlung über, mit einer Doxycyclin-Gabe in den ersten Tagen, gefolgt von einem zweiten Antibiotikum nach Erhalt des Resistenztest-Befunds. Als in 2022/2023 Pristinamycin zunehmend weniger verfügbar wurde, setzen wir nach den optimistischen Daten aus Melbourne zunehmend Minocyclin über 14 Tage ein – teils nach einigen Tagen Doxycyclin vorweg.
Hoffnungsträger Minocyclin
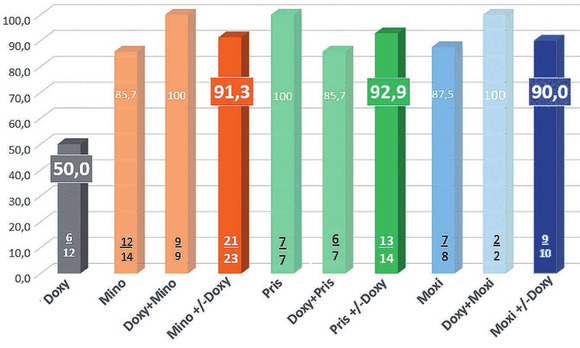
Abb. 5 Therapieerfolg bei Doppel-Resistenz (%)
Hierbei zeigte sich Minocyclin als eine durchaus sehr hoffnungsvolle Substanz in der Behandlung doppelt-resistenter MG-Stämme. Mehr als 90% aller Minocyclin-haltigen Therapien führten zu einer Eradikation dieser schwer zu behandelnden Stämme (Abb. 5).
Empfehlung
Zusammenfassend kann man also davon ausgehen, dass bei MSM – zumindest in Berlin – fast 90% Makrolid-resistente MG-Stämme vorkommen und in etwa einem Drittel doppel-resistente Stämme vorliegen. Bei heterosexuellen Männern und bei Frauen finden sich in etwa der Hälfte der Fälle Makrolid-Resistenzen und in etwas mehr als 10% doppelt-resistente Stämme. Wissend um diese hohen – und im zeitlichen Verlauf ansteigenden (!) – Resistenzraten, empfehlen wir dringend das Konzept der resistenzgesteuerten sequenziellen Therapie. Die Behandlung einer Mycoplasma genitalium-Infektion ohne Resistenztestung stellt einen therapeutischen Blindflug dar, der die Gefahr weiterer therapieinduzierter Resistenzen bei ohnehin schon wenigen antibiotischen Therapieoptionen birgt.
Doxy-PEP und Resistenz
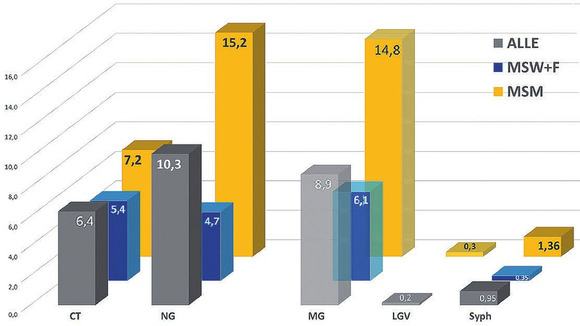
Abb. 6 STI bei allen Patient*innen sowie MSM. CT = Chlaymdia trachomatis, NG = Neisseria gonorrhoae, LVG = Lymphogranuloma venereum, Syph = Syphilis
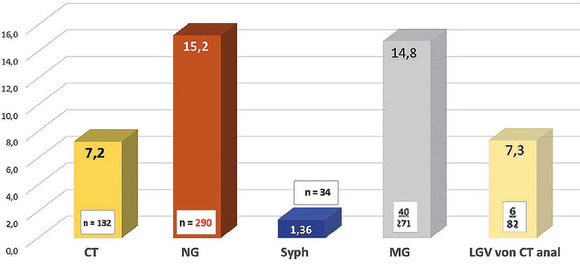
Abb. 7 Alle untersuchten MSM (n=1.908)
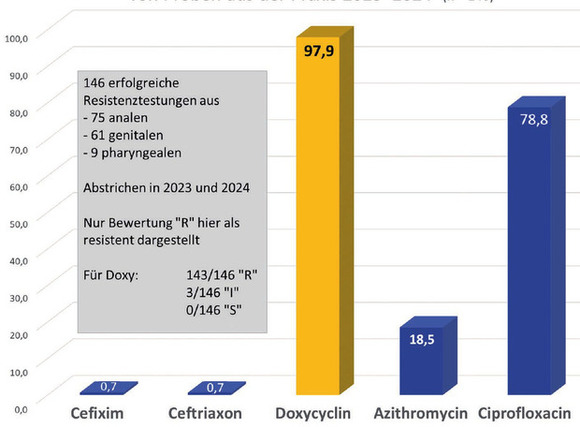
Abb. 8 Gonokokken: Resistenzraten (%) von Proben aus der Praxis 2023 + 2024 (n=146)
In Zeiten einer lebhaften Diskussion über die vermeintlichen Vorteile der Doxy-PEP zur Vermeidung von STI haben wir die in unserer Praxis erfolgten STI-Testungen über einen Zeitraum von achteinhalb Monaten (Mitte November 2023 bis Ende Juli 2024) ausgewertet und ebenfalls beim DSTIG-Kongress vorgestellt.
Abstrich-,
Erststrahl-Urin- und Blutproben von 3.587 Patient*innen, die sich zur
STI-Testung in unserer Praxis vorgestellt haben, wurden ausgewertet.
Nicht in die Analyse eingeflossen sind Tests of Cure. Zudem wurden
146 positive Gonokokken-Antibiogramme im Zeitraum Januar 2023 bis
Juli 2024 ausgewertet. Tests auf
Mycoplasma genitalium
erfolgten nur bei einem Bruchteil der Untersuchten (n=762), die eine
verdächtige Symptomatik aufwiesen. Bei allen Nachweisen von
Chlamydien im Anus (n=82) erfolgte eine Nachtestung auf LGV
(Chlamydien-Serogruppe L1-L3). In die Auswertung flossen neben den
spezifisch auf STI getesteten Patient*innen auch die Befunde der im
Rahmen ihrer regelmäßigen Quartals-Checks auch auf Syphilis
getesteten HIV-Patient*innen mit ein. Somit gingen etwa 4.400
Syphilis-Tests in die Analyse ein. Unter den 3.587 untersuchten
Patient*innen waren 1.908 Männer, die Sex mit Männern hatten und
potenziell für eine Doxy-PEP infrage kommen.
Häufigste STI
Sowohl in der Gesamtgruppe als auch in der Subgruppe der MSM waren Gonokokken-Nachweise die mit Abstand häufigsten detektierten STI (Abb. 6). In der Gruppe der MSM waren Gonokokken-Infektionen mit 15,2% mehr als doppelt so häufig nachweisbar wie Chlamydien (7,2%).
STI bei Doxy-PEP
Betrachtet man jetzt nur die für eine Doxy-PEP infrage kommenden 1.908 MSM, so ließen sich im Analysezeitraum 290 Fälle von Gonokokken-, 132 Chlamydien-, 34 Syphilis-, 6 LGV- und 40 Mycoplasma genitalium-Infektionen nachweisen (Abb. 7).
Bei 146 erfolgreich kultivierten Gonokokkenstämmen konnte ein Antibiogramm erhoben werden. Nahezu alle Stämme waren gegen Doxycyclin resistent. In etwa einem Fünftel bestand eine Resistenz gegen Azithromycin (Abb. 8).
Empfehlung
Zusammenfassend kann also gesagt werden, dass Gonokokken-Infektionen aktuell den mit Abstand größten Teil der STI bei MSM ausmachen. Syphilis-Nachweise sind mit 1,36% selten. LGV-Nachweise ebenfalls. Die in Berlin zirkulierenden Gonokokken sind nahezu immer gegen Doxycyclin resistent. Die prophylaktische Gabe von Doxycyclin zur Verhinderung von STIs erscheint deshalb in Anbetracht der Epidemiologie und Resistenzsituation wenig sinnvoll.









 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen