Tobias Tix und Kai Rejeski, München
Infektionen nach CAR-T-Zelltherapie
Die CAR-T-Zelltherapie hat die Behandlung von therapierefraktären und rezidivierten hämatologischen Neoplasien revolutioniert, bringt jedoch spezifische Nebenwirkungen wie das Cytokine Release Syndrome (CRS) oder neurotoxische Erscheinungen (ICANS) mit sich. Zusätzlich sind Zytopenien und Infektionen häufige Komplikationen.1,2
In
einer aktuellen Metaanalyse wurden die Daten von 7.604 Patient*innen
aus 18 klinischen Studien und 28 Real-World Analysen im Hinblick auf
die Nicht-Rezidiv-Mortalität (NRM/non-relapse mortality)
ausgewertet. Die NRM-Rate war beim Mantelzell-Lymphom am höchsten
(10,6%) gefolgt vom multiplen Myelom (8,0%), dem großzelligen B
Zell-Lymphom (6,1%) und
dem indolenten Lymphom (5,7%).
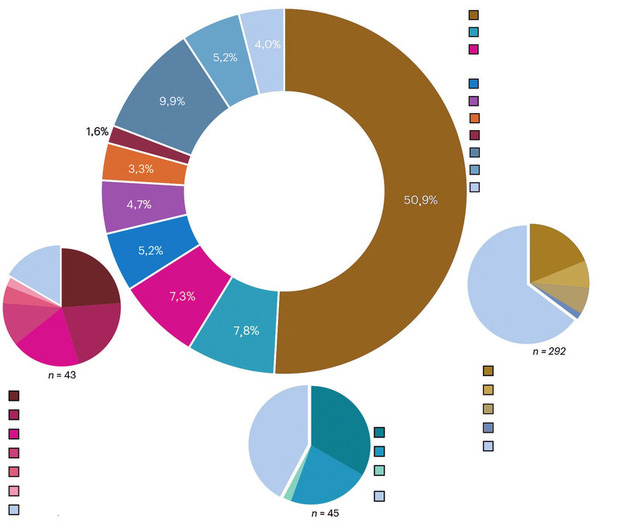
Abb. 1 Nicht-Rezidiv assoziierte Todesursachen über alle Erkrankungen und CAR-T-Produkte In der Ringgrafik werden bekannte unterschiedliche Todesursachen in verschiedenen Farben dargestellt, die unklaren und nicht klassifizierbaren Todesursachen in hellblau. In den Tortengrafiken werden Nicht-Rezidiv assoziierte Todesursachen unterteilt in Tod durch Infekt (braune Farben), Tod durch sekundäre Malignome (türkise Farben) und Tod durch kardiovaskuläre Ereignisse (pinke Farben). (Abb. nach Cordas Dos Santos et al., Nat. Med. 2024)
Infektionen waren dabei mit ca. 51% die häufigste Todesursache von den 574 registrierten non-relapse Todesfällen. Andere Todesursachen wie sekundäre Malignome (7,8%) oder kardiovaskuläre/respiratorische Ereignisse (7,3%) waren deutlich seltener. Die bekannten typischen Nebenwirkungen der CAR-T-Therapie wie CRS, ICANS und hämophagozytische Lymphohistiozytose spielten im Hinblick auf die NRM (kumulativ 11,5%) eine untergeordnete Rolle (Abb. 1).3,4
Infektionsrisiken
Infektionen
treten in allen Phasen der CAR-T-Therapie auf und werden durch eine
Kombination aus zellulären und humoralen Immundefiziten begünstigt
(Abb. 2).2
Die lymphodepletierende Chemotherapie vor der Infusion führt zu
einer ausgeprägten Neutropenie, die in manchen Fällen auch über
einen längeren Zeitraum anhalten kann.
Darüber hinaus führen
die „on-target/off-tumor“-Effekte der CD19- oder BCMA-gerichteten
CAR-T-Zellen zu einer längerfristigen B-Zell-Depletion und
Hypogammaglobulinämie. Weiterhin beeinträchtigen CAR-T-spezifische
Komplikationen wie CRS und ICANS die Immunfunktion weiter,
insbesondere wenn eine intensive immunsuppressive Behandlung
erforderlich wird. Nicht zuletzt sind jedoch auch die
zugrundeliegende onkologische Erkrankung, frühere Therapielinien
sowie etwaige Komorbiditäten relevante Risikofaktoren.
Der erste Monat nach der CAR-T-Zellinfusion ist vor allem durch eine erhöhte Anfälligkeit für bakterielle Infektionen geprägt. Sowohl verlängerte Neutropeniephasen als auch der Einsatz hochdosierter Glukokortikoide führen in selteneren Fällen auch zu Pilzinfektionen. Nach den ersten vier Wochen verschiebt sich das Infektionsspektrum durch die längerfristige B-Zell-Depletion eher zugunsten viraler Erreger.
Klinisches Management
In jeder Phase der Therapie – von der Vorbereitung über die Wochen unmittelbar nach CAR-T-Infusion bis hin zur Langzeitbetreuung – sollte die Behandlung von CAR-T-Patient*innen an oder in enger Rücksprache mit spezialisierten Zentren erfolgen, die über die notwendige Expertise und Infrastruktur verfügen, um die Komplikationen dieser Therapie zu bewältigen. 5,6
Bereits vor der CAR-T-Infusion ist eine frühzeitige Risikobewertung wichtig, beispielsweise durch den CAR-HEMATOTOX-Score (Abb. 2).7,8 Dieser umfasst Parameter der hämatopoetischen Reserve (Differential-Blutbild) und der systemischen Inflammation (CRP, Ferritin). Zusätzlich sollte vor Beginn der Therapie ein umfassendes Screening auf Infektionskrankheiten, einschließlich HIV und Hepatitis, erfolgen und der Immunstatus mittels Lymphozyten-Subpopulationsanalyse überprüft werden. Eine Prophylaxe bei positivem Hepatitis B Status ist empfohlen.
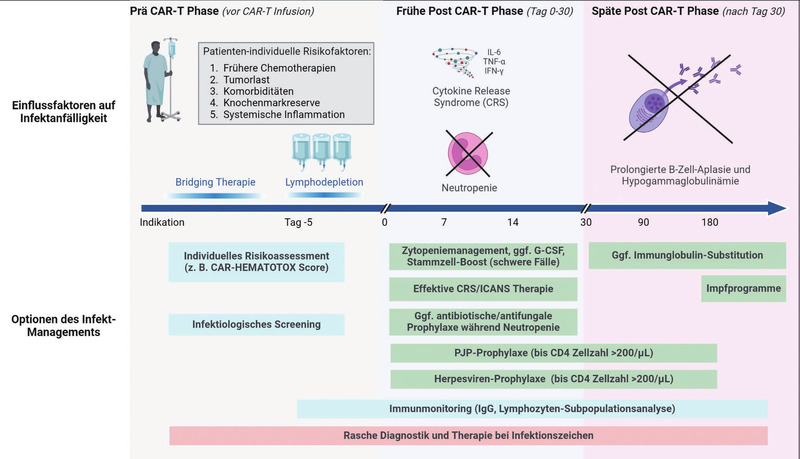
Abb. 2 Risikofaktoren und Management von Infektionen bei CAR-T-Zell-Patient*innen
Bei Hochrisikopatient*innen wird häufig eine prophylaktische Gabe von Antibiotika und Antimykotika eingesetzt. Cotrimoxazol (bspw. 960 mg dreimal wöchentlich) und Aciclovir (bspw. 400 mg 1-0-1) sind Standard zur Pneumocystis- und Herpesprophylaxe. Während der Phase der Neutropenie kann der frühzeitige Einsatz von Wachstumsfaktoren wie G-CSF helfen, die Dauer der Neutropenie zu verkürzen.
Rasch therapieren
Im Falle einer Infektion ist schnelles Handeln essenziell. Bereits bei Verdacht auf eine bakterielle Infektion sollte sofort eine empirische antibiotische Therapie eingeleitet werden. Parallel dazu sollte eine gezielte Diagnostik durchgeführt werden, um die genaue Ursache der Infektion – bakteriell, viral oder fungal – zu identifizieren und die Behandlung entsprechend anzupassen. Differentialdiagnostisch muss bei auftretendem Fieber gerade in der frühen Phase auch an ein CRS gedacht werden, das wiederum eine immunsuppressive Therapie notwendig machen kann. Der Serummarker Procalcitonin (≥1.5 µg/L) kann beim ersten Fieber nach Infusion helfen, (bakterielle) Infektionen im Kontext des CRS zu identifizieren.9,10
Nachsorge
Langfristig erfordert die Betreuung von CAR-T-Patient*innen eine engmaschige Nachsorge. Regelmäßige Kontrollen der Immunparameter, wie IgG-Spiegel und Lymphozyten-Subpopulationen, sind dabei von zentraler Bedeutung. Darüber hinaus sollten Impftiter bestimmt und Impfprogramme initiiert werden, um die Infektanfälligkeit zu senken, sobald die Immunrekonstitution dies erlaubt. Dies umfasst vor allem Impfungen gegen COVID-19, Influenza und RSV – auch für Angehörige. Bei Patient*innen mit persistierender Hypogammaglobulinämie (IgG Spiegel <4 g/L) und rekurrenten Infektionen kann die regelmäßige Gabe von Immunglobulinen helfen, schweren Infektionen aufgrund der sekundären Immundefizienz vorzubeugen.
Fazit
Infektionen sind eine häufige und potenziell lebensbedrohliche Komplikation der CAR-T-Zelltherapie. Ein strukturiertes Management, das Prävention, engmaschige Überwachung und rasche Intervention kombiniert, ist entscheidend, um die Mortalität zu senken und den Erfolg der Therapie langfristig zu sichern.
1 Rejeski K, Jain MD, Shah NN, Perales MA, Subklewe M. Immune effector cell-associated haematotoxicity after CAR T-cell therapy: from mechanism to management. Lancet Haematol. Jun 2024;11(6):e459-e470. doi:10.1016/S2352-3026(24)00077-2
2 Kampouri E, Little JS, Rejeski K, Manuel O, Hammond SP, Hill JA. Infections after chimeric antigen receptor (CAR)-T-cell therapy for hematologic malignancies. Transpl Infect Dis. Oct 3 2023:e14157. doi:10.1111/tid.14157
3 Cordas Dos Santos DM, Tix T, Shouval R, et al. A systematic review and meta-analysis of nonrelapse mortality after CAR T cell therapy. Nat Med. Jul 8 2024;doi:10.1038/s41591-024-03084-6
4 Tix T, Subklewe M, von Bergwelt-Baildon M, Rejeski K. Survivorship in Chimeric Antigen Receptor T-Cell Therapy Recipients: Infections, Secondary Malignancies, and Non-Relapse Mortality. Oncol Res Treat. Nov 19 2024:1-7. doi:10.1159/000542631
5 Hayden PJ, Roddie C, Bader P, et al. Management of adults and children receiving CAR T-cell therapy: 2021 best practice recommendations of the European Society for Blood and Marrow Transplantation (EBMT) and the Joint Accreditation Committee of ISCT and EBMT (JACIE) and the European Haematology Association (EHA). Ann Oncol. Mar 2022;33(3):259-275. doi:10.1016/j.annonc.2021.12.003
6 Shahid Z, Jain T, Dioverti V, et al. Best Practice Considerations by The American Society of Transplant and Cellular Therapy: Infection Prevention and Management After Chimeric Antigen Receptor T Cell Therapy for Hematological Malignancies. Transplant Cell Ther. Oct 2024;30(10):955-969. doi:10.1016/j.jtct.2024.07.018
7 Rejeski K, Hansen DK, Bansal R, et al. The CAR-HEMATOTOX score as a prognostic model of toxicity and response in patients receiving BCMA-directed CAR-T for relapsed/refractory multiple myeloma. J Hematol Oncol. Jul 31 2023;16(1):88. doi:10.1186/s13045-023-01465-x
8 Rejeski K, Perez A, Iacoboni G, et al. The CAR-HEMATOTOX risk-stratifies patients for severe infections and disease progression after CD19 CAR-T in R/R LBCL. J Immunother Cancer. May 2022;10(5)doi:10.1136/jitc-2021-004475
9 Powell MZ, Mara KC, Bansal R, et al. Procalcitonin as a biomarker for predicting bacterial infection in chimeric antigen receptor T-cell therapy recipients. Cancer Med. Apr 2023;12(8):9228-9235. doi:10.1002/cam4.5665
10 Rejeski K, Blumenberg V, Iacoboni G, et al. Identifying Early Infections in the Setting of CRS With Routine and Exploratory Serum Proteomics and the HT10 Score Following CD19 CAR-T for Relapsed/Refractory B-NHL. Hemasphere. Apr 2023;7(4):e858. doi:10.1097/HS9.0000000000000858









 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen