Guido Kobbe, Düsseldorf
Sekundärneoplasien und sekundäre T-Zell Lymphome nach CAR-T-Zelltherapie
Seit der ersten Zulassung 2017 wurden in den USA bis Ende 2023 etwa 27.000 CAR-T-Zelltherapien durchgeführt, in Europa bis 2024 rund 10.000 (Verdun, EBMT). Besonders häufig werden Patienten mit aggressiven B-Zell Lymphomen behandelt, zunehmend auch in frühen Therapielinien. Ähnliches gilt für das Multiple Myelom. Experten erwarten zudem eine Ausweitung der Therapie auf weitere Indikationen, insbesondere bei Autoimmunerkrankungen.
Im November 2023 warnte die FDA, dass es nach CAR-T-Zelltherapie vereinzelt zu malignen T-Zell Lymphomen gekommen sei. Die EMA bestätigte im Juli 2024, dass weltweit etwa 42.500 Patienten mit CD19- oder BCMA-gerichteten CAR-T-Zellen behandelt und darunter 38 Fälle von T-Zell Lymphomen oder -Leukämien gemeldet worden waren. In sieben Fällen konnte der CAR-Vektor nachgewiesen werden.
Erhöhte Aufmerksamkeit?
Berichte über sekundäre T-Zell Lymphome nach CAR-T-Zelltherapie führten zu mehreren retrospektiven Studien zur generellen Häufigkeit sekundärer Neoplasien nach CAR-T-Zelltherapie. Dabei zeigte sich, dass das Spektrum der sekundären primären Malignome (SPM) nach CAR-T-Zelltherapie dem nach anderen Therapieformen wie der Immunchemo- oder Radiochemotherapie ähnelt (Storgard, Elsallab, Hamilton). Einige Studien deuten jedoch auf eine erhöhte SPM (Secondary Primary Malig-nancy)-Rate hin, was teils auf erhöhte Wachsamkeit und Berichtspflicht, teils auf die extensive Vorbehandlung der Patienten mit genotoxischen Substanzen zurückgeführt wird.
Spektrum
Elsallab et al. analysierten 12.394 Berichte aus dem FDA Adverse Event Reporting System (FAERS) zur CAR-T-Zelltherapie. Von 2.225 Fällen mit dem label „Neoplasmen, gutartig, bösartig und nicht spezifiziert“ wurden 4% als SPM klassifiziert. Leukämien und myelodysplastische Syndrome (MDS) waren mit 62% am häufigsten, gefolgt von Hautneoplasien (10%), Tumoren des Nervensystems (4%) und Atemwegstumoren (4%). T-Zell Lymphome waren 3% der SPM und 0,1% aller Berichte. Hamilton et al. berichteten in einer unizentrischen Studie mit 724 Patienten nach CAR-T-Zelltherapie eine kumulative SPM-Rate von 9% nach 3 Jahren. Es wurden 3% SPM beobachtet, 52% davon myeloische Neoplasien und 44% solide Tumoren. T-Zell Lymphome waren mit 4% bzw. 0,1% selten. Auch Ghilardi et al. fanden bei 449 Patienten nach CD19- oder BCMA-CAR-T-Zellen nur ein T-Zell Lymphom.
Sekundäre T-Zell Lymphome
Sekundäre T-Zell Lymphome nach CAR-T-Zelltherapie verdienen besondere Aufmerksamkeit. Dies liegt daran, dass bei CAR-T-Zelltherapien theoretisch zusätzliche Mechanismen zur Tumorentstehung beitragen könnten. Bei der CAR-T-Zell-Herstellung wird die DNA der T-Zellen genetisch verändert, wodurch das Risiko einer malignen Transformation der T-Zellen bestehen könnte. Ein Beispiel für dieses Risiko wurde bei der Herstellung von CAR-T-Zellen mittels PiggyBac-Verfahren deutlich. In einer frühen klinischen Studie traten bei einigen Patienten T-Zell-Lymphome auf, die wahrscheinlich mit der genetischen Manipulation zusammenhingen (Micklethwaite).
Allerdings basiert keine der derzeit in den USA oder Europa zugelassenen CAR-T-Therapien auf diesem Verfahren. Stattdessen wird die lentivirale Transduktion genutzt, bei der ein CAR-Vektor mittels Lentivirus in die T-Zellen eingebracht wird. Bisher konnte bei diesem Verfahren keine maligne Transformation von T-Zellen nachgewiesen werden. Da dieses Risiko jedoch theoretisch besteht, sollten alle sekundären T-Zell Lymphome nach CAR-T-Zelltherapie molekulargenetisch untersucht werden.
SPM oder nicht?
Um zu belegen, dass ein T-Zell Lymphom aus einer transduzierten T-Zelle stammt, muss die Integration des CAR-Vektors ins Genom bzw. seine Expression auf der Zelloberfläche nachgewiesen werden. Aber auch wenn dies gelingt, bedeutet es nicht zwangsläufig, dass die genetische Manipulation Ursache der malignen Transformation war.
In der Regel sind mehrere genetische Veränderungen notwendig, um malignes Zellwachstum zu induzieren und nur wenige T-Zell Lymphome nach CAR-T-Zelltherapie wurden bisher ausreichend untersucht, um die Mechanismen Tumorentstehung zu klären. Es wurden sowohl CAR-positive als auch CAR-negative T-Zell Lymphome gefunden. Bei CAR-negativen Lymphomen kann im Gegensatz zu den CAR-positiven T-Zell Lymphomen keine Integration des CAR-Vektors nachgewiesen werden. Diese beiden Gruppen sollten getrennt betrachtet und analysiert werden.
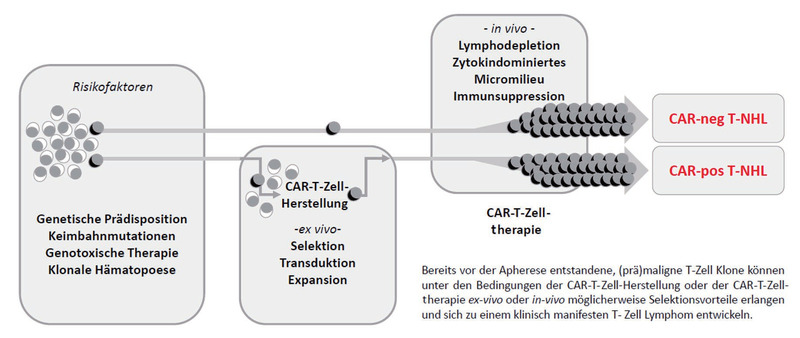
Abb. 1 Schematische Darstellung der Entstehung sekundärer T-Zell Lymphome nach CAR-T-Zelltherapie
CAR-negative T-Zell Lymphome
CAR-negative sekundäre T-Zell Lymphome zeichnen sich dadurch aus, dass der lentivirale CAR-Vektor weder im Genom noch auf der Oberfläche der malignen T-Zellen nachgewiesen werden kann. Doch wie entstehen diese Lymphome?
Hamilton et al. beschrieben ein aggressives CD4+ T-Zell Lymphom bei einem Patienten nach CAR-T-Zelltherapie mit Axicabtagene Ciloleucel (axi-cel, Yescarta). Das Lymphom trat etwa 50 Tage nach der Behandlung auf und führte schnell zum Tod des Patienten. Eine genetische Analyse zeigte keine Integration des CAR-Vektors, jedoch Mutationen in TET2 und DNMT3A, die auch im ursprünglichen B-Zell-Lymphom des Patienten vorhanden waren. Dies deutet auf eine gemeinsame, klonal mutierte lymphatische Vorläuferzelle (klonale Hämatopoese, CHIP) hin. Der T-Zell-Klon konnte bereits in Gewebeproben nachgewiesen werden, die vor der CAR-T-Zelltherapie entnommen worden waren.
Ein ähnlicher Fall wurde von Godfrey et al. beschrieben. Auch hier fanden sich TET2- und DNMT3A-Mutationen, was ebenfalls auf eine CHIP hinweist. Ghilardi et al. berichteten über ein weiteres T-Zell Lymphom etwa drei Monate nach CAR-T-Zelltherapie. Der CAR-Vektor konnte im Lymphom nicht in relevanter Menge nachgewiesen werden, dafür jedoch unter anderem eine JAK3-Mutation. Auch hier war der spezifische T-Zell-Klon bereits vor der Therapie im peripheren Blut des Patienten vorhanden.
Studien zeigen, dass Patienten mit B-Zell-Lymphomen generell ein erhöhtes Risiko für T-Zell Lymphome haben. Chihara et al. fanden bei 288.478 Patienten mit B-Zell Lymphomen insgesamt 354 T-Zell Lymphome (0,12%), was etwa einer fünfmal höheren Inzidenz im Vergleich zur Normalbevölkerung entspricht. Diese traten meist innerhalb der ersten zwei Jahre nach der Diagnose des B-Zell Lymphoms auf, was auch den zeitlichen Zusammenhang der sekundären T-Zell Lymphome zur CAR-T-Zelltherapie erklären könnte.
Eine weitere Erklärung könnte die therapeutische Lymphodepletion vor der CAR-T-Zell-Infusion sein. Diese schafft ein Mikromilieu, das die Proliferation von T-Zellen fördert, um eine effektive CAR-T-Zell-Expansion zu ermöglichen. In Kombination mit der durch die CAR-T-Zell-Expansion induzierten Zytokinausschüttung und sekundären Immunsuppression könnte dieses Milieu jedoch auch das Wachstum (prä)maligner T-Zell-Klone begünstigen und so die Entstehung von T-Zell Lymphomen fördern.
CAR+ T-Zell Lymphome
In den meisten bisher beschriebenen Fällen von T-Zell Lymphomen nach CAR-T-Zelltherapie konnte der CAR-Vektor im Genom der malignen T-Zellen nachgewiesen werden. Ein solcher Fall wurde von Kobbe et al. beschrieben: Etwa 50 Tage nach der Therapie eines rezidivierten primären ZNS-B-Zell Lymphoms mit Tisagenlecleucel (tisa-cel, Kymriah) trat ein aggressives T-Zell Lymphom auf. Innerhalb weniger Tage kam es zu einer massiven Expansion klonaler T-Zellen in Blut und Knochenmark. Die Zellen wiesen einen pathologischen CD3+CD4-CD8-Phänotyp auf, und der CAR-Vektor konnte sowohl im Genom als auch auf der Zelloberfläche der malignen Zellen nachgewiesen werden.
Die Analyse der Integrationsorte zeigte, dass der CAR-Vektor in die Gene DPF2, RAB11FIP3 und NPLOC4 integriert war. Diese Gene sind jedoch keine bekannten Krebsgene, sodass die virale Integration allein keine plausible Erklärung für die Entstehung des Lymphoms bot. Stattdessen wurden zwei pathologische Mutationen in TET2 und eine Mutation in DNMT3A nachgewiesen. Diese beiden Gene sind häufig in T-Zell Lymphomen mutiert (Scourzic). Sensitive PCR- und Sequenzierungsanalysen wiesen die pathologischen Mutationen sowie den klonalen T-Zell-Rezeptor bereits im Apheresat vor der CAR-T-Zell-Herstellung nach. Eine der TET2-Mutationen und die DNMT3A-Mutation fanden sich zudem in älteren Blutproben des Patienten. Dies deutete darauf hin, dass ein prämaligner T-Zell-Klon bereits vor der Therapie existierte, der durch die CAR-T-Zell-Herstellung expandierte und nach Re-Infusion zu einem klinisch manifesten Lymphom führte.
Perica et al. beschrieben ein CAR-positives T-Zell-Lymphom nach Therapie mit Ciltacabtagene Autoleucel (cilta-cel, Carvykti). Der CAR-Vektor war in das TP53-Gen integriert, welches eine wichtige Rolle in der Tumorpathogenese spielt. Allerdings blieb unklar, ob diese Integration die Tumorentstehung verursachte, da ähnliche Integrationen bereits ohne klonale Expansion beschrieben wurden (Nobles). Neben der TP53-Integration wurden auch eine Mutation in SOCS1 nachgewiesen, einem bekannten Tumorsuppressor.
Harrison
et al. berichteten über zwei Patienten mit CAR-positiven T-Zell
Lymphomen nach cilta-cel-Therapie. Beide zeigten pathologische
TET2-Mutationen, die bereits Jahre vor der Therapie in niedriger
Frequenz nachweisbar waren. Beide Patienten hatten eine
Hautbeteiligung und einen CD3+CD4-CD8-Phänotyp. In einem Fall wurde
der CAR-Vektor in PBX2, im anderen in ARID1A integriert. Diese Gene
wurden bereits mit Tumoren assoziiert, jedoch blieben die genauen
Auswirkungen der Integrationen unklar. Dulery et al. beschrieben ein
Lymphom nach tisa-cel-Therapie mit Vektorintegration in PLAAT4, einem
Tumorsuppressor-Gen unbekannter Funktion. Eine detaillierte
genomische Analyse wurde hier nicht durchgeführt. Ozdemirli et al.
berichteten über eine Patientin mit einem
T-Zell Lymphom fünf
Monate nach cilta-cel-Therapie. Hier fand sich die Vektorintegration
in SSU72, einem Gen, das die T-Zell-Homöostase reguliert. Es gab
jedoch keinen Hinweis auf eine veränderte SSU72-mRNA-Expression, und
zusätzlich wurden zahlreiche weitere genetische Aberrationen
gefunden, die das Lymphom verursacht haben könnten.
Die insertionale Mutagenese bei der CAR-T-Zell-Herstellung könnte theoretisch das Risiko für maligne Transformationen beeinflussen. Studien zeigen, dass sie das Verhalten einzelner T-Zell-Klone und deren therapeutische Effektivität nach der Infusion beeinflusst (Nobles, Shah, Fraietta). Bezüglich des Risikos für eine maligne Transformation ist in Abwesenheit direkter Beweise in allen derzeit beschriebenen CAR-positiven T-Zell Lymphomen jedoch unklar, ob und inwieweit die insertionale Mutagenese zur Entwicklung der T-Zell Lymphome beigetragen hat.
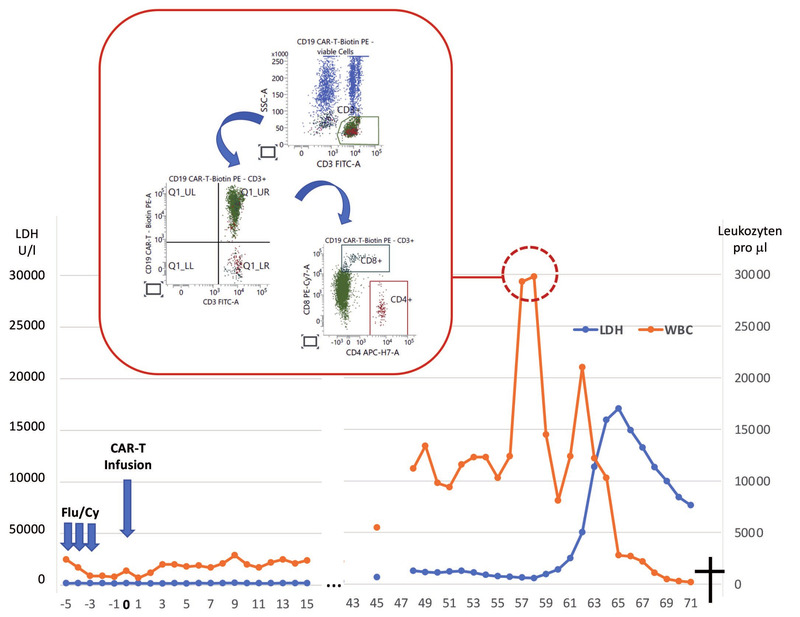
Abb. 2 Klinischer Verlauf eines Patienten mit sekundärem CAR+ T-Zell Lymphom (Kobbe, NEJM 2024). Etwa 50 Tage nach der CAR-T-Zelltherapie kam es zu einer massiven Expansion CD4-CD8-klonaler T-Zellen, die über eine HLH und DIC trotz Therapie zum Tod des Patienten führten
Konsequenzen
CAR-positive T-Zell Lymphome nach CAR-T-Zelltherapie sind äußerst selten. Das Risiko liegt bei nur 0,01% bis 0,1%, während das allgemeine Risiko für Sekundärneoplasien nach CAR-T-Zelltherapie bei etwa 3–5% liegt, also vergleichbar mit anderen zytotoxischen Therapien. Jüngere Patienten haben ein noch geringeres Risiko (Lamble).
Dies deutet darauf hin, dass die Insertionsmutagenese durch den CAR-Vektor ein nur sehr geringes Risiko für eine maligne Transformation der CAR-T-Zellen birgt. Wichtiger sind offenbar Faktoren wie eine klonale Hämatopoese (CHIP) und genotoxische Belastungen vor der CAR-T-Zelltherapie, die zur Anhäufung von Risikomutationen zum Beispiel in TET2 und DNMT3A führen können. In einigen Fällen konnten diese pathologischen T-Zell-Klone bzw. die relevanten Mutationen bereits vor der CAR-T-Zell-Herstellung nachgewiesen werden.
Da die CAR-T-Zelltherapie oft die einzige kurative Option bei fortgeschrittenen hämatologischen Neoplasien ist, erscheint das Risiko für Sekundärneoplasien, insbesondere für sekundäre T-Zell Lymphome, vertretbar.
Mit dem zunehmenden Einsatz der CAR-T-Zelltherapie in frühen Therapielinien und bei nicht-malignen Erkrankungen gewinnt das Risiko für sekundäre T-Zell Lymphome aber zunehmend an Bedeutung. Eine gründliche histologische und molekulargenetische Analyse jedes einzelnen Falles ist deshalb essenziell, um die Pathogenese besser zu verstehen. Ein generelles Screening auf CHIP ist wissenschaftlich sinnvoll, in der täglichen Praxis jedoch derzeit nicht hilfreich, da zuverlässige Risikoeinschätzungen noch fehlen.
Chihara, D., et al., The bidirectional increased risk of B-cell lymphoma and T-cell lymphoma. Blood, 2021. 138(9): p. 785-789.
Dulery, R., et al., T cell malignancies after CAR T cell therapy in the DESCAR-T registry. Nat Med, 2025.
Elsallab, M., et al., Second primary malignancies after commercial CAR T-cell therapy: analysis of the FDA Adverse Events Reporting System. Blood, 2024. 143(20): p. 2099-2105.
https://www.ebmt.org/ebmt/news/ebmt-reaches-major-milestone-10000-car-t-treated-patients-registered-its-registry#:~:text=Home%20%2F-,The%20EBMT%20reaches%20major%20milestone%3A%2010%2C000%20CAR%2DT%20treated,patients%20registered%20in%20its%20Registry&text=The%20EBMT%20is%20proud%20to,CAR%2DT)%20therapy%20patients.
Fraietta, J.A., et al., Disruption of TET2 promotes the therapeutic efficacy of CD19-targeted T cells. Nature, 2018. 558(7709): p. 307-312.
Ghilardi, G., et al., T cell lymphoma and secondary primary malignancy risk after commercial CAR T cell therapy. Nat Med, 2024. 30(4): p. 984-989.
Hamilton MP, et al., Risk of Second Tumors and T-Cell Lymphoma after CAR T-Cell Therapy. N Engl J Med. 2024 Jun 13;390(22):2047-2060. doi: 10.1056/NEJMoa2401361.
Harrison, S.J., et al., CAR+ T-Cell Lymphoma after Cilta-cel Therapy for Relapsed or Refractory Myeloma. N Engl J Med, 2025. 392(7): p. 677-685.
Kobbe, G., et al., Aggressive Lymphoma after CD19 CAR T-Cell Therapy. N Engl J Med, 2024. 391(13): p. 1217-1226.
Lamble, A.J., et al., Risk of T-cell malignancy after CAR T-cell therapy in children, adolescents, and young adults. Blood Adv, 2024. 8(13): p. 3544-3548.
Micklethwaite, K.P., et al., Investigation of product-derived lymphoma following infusion of piggyBac-modified CD19 chimeric antigen receptor T cells. Blood, 2021. 138(16): p. 1391-1405.
Nobles, C.L., et al., CD19-targeting CAR T cell immunotherapy outcomes correlate with genomic modification by vector integration. J Clin Invest, 2020. 130(2): p. 673-685.
Ozdemirli, M., et al., Indolent CD4+ CAR T-Cell Lymphoma after Cilta-cel CAR T-Cell Therapy. N Engl J Med, 2024. 390(22): p. 2074-2082.
Perica, K., et al., CD4+ T-Cell Lymphoma Harboring a Chimeric Antigen Receptor Integration in TP53. N Engl J Med, 2025. 392(6): p. 577-583.
Scourzic, L., et al., DNMT3A(R882H) mutant and Tet2 inactivation cooperate in the deregulation of DNA methylation control to induce lymphoid malignancies in mice. Leukemia, 2016. 30(6): p. 1388-98.
Shah, N.N., et al., Clonal expansion of CAR T cells harboring lentivector integration in the CBL gene following anti-CD22 CAR T-cell therapy. Blood Adv, 2019. 3(15): p. 2317-2322.
Storgard, R., et al., T-Cell Malignant Neoplasms After Chimeric Antigen Receptor T-Cell Therapy. JAMA Oncol, 2024. 10(6): p. 826-828.
Verdun, N. and P. Marks, Secondary Cancers after Chimeric Antigen Receptor T-Cell Therapy. N Engl J Med, 2024. 390(7): p. 584-586.









 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen