Marcus Hentrich, München
Therapie mit CAR-T-Zellen
CAR-T-Zellen sind autologe T-Zellen, die mit Hilfe eines lenti- oder retroviralen Vektors gentechnisch modifiziert und mit einem Antigen-bindenden Rezeptor (chimeric antigen receptor, CAR) zur Erkennung einer Zielstruktur ausgestattet werden. Durch die extrazelluläre Domäne des CARs, die vom Single-chain variable fragment (scFv)-Segment der Antigen-Bindungsregion eines monoklonalen Antikörpers abgeleitet ist, werden Zielantigene wie z.B. CD19 oder B-cell maturation antigen (BCMA) auf Tumorzellen unabhängig vom endogen exprimierten T-Zell-Rezeptor (TCR) erkannt und gebunden. Somit benötigen sie keine Prozessierung und Präsentation des Zielantigens durch antigenpräsentierende Zellen.
Grundlagen
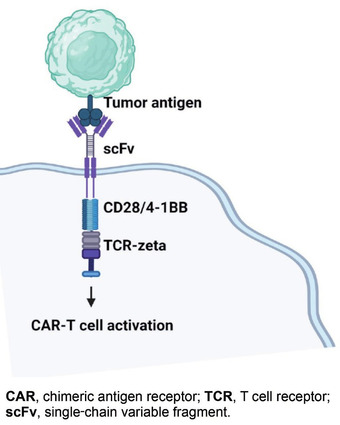
Abb. 1 Schematische Darstellung eines CARs1
Neben der extrazellulären Bindungsdomäne gegen das jeweilige Zielantigen verfügt ein CAR über eine Transmembrandomäne, die den CAR in der Zelle verankert und dessen Stabilität sowie die Signalweiterleitung beeinflusst. Zudem besitzt ein CAR intrazelluläre Domänen, die Bestandteile des T-Zell-Rezeptors aufweisen, und in eine kostimulatorische Domäne (meist CD28 oder 4-1BB) und eine signalaktivierende Domäne (meist CD3ζ) unterteilt werden1 (Abb. 1). Durch Kostimulation soll die Immuntoleranz bzw. Anergie der T-Zellen gegenüber Tumorantigenen durch Proliferation und Aktivierung des CARs überwunden und die T-Zell-Effektorfunktion verstärkt werden. Die signalaktivierende Domäne dient ebenfalls der Aktivierung der CAR-T-Zellen nach Bindung an das Antigen.
Die T-Zellen des Patienten werden durch Leukapherese gewonnen und in das verarbeitende Labor geschickt, wo die technisch sehr aufwendige Prozessierung mit anschließender Kryokonservierung erfolgt. Dieser Prozess dauert ca. 3 Wochen und nimmt somit deutlich weniger Zeit in Anspruch als noch vor einigen Jahren, da die Herstellung mittlerweile auch in Europa möglich ist.
Das kryokonservierte CAR-T-Zell-Konstrukt wird dann in die jeweilige Klinik transportiert, aufgetaut und dem Patienten, der zuvor eine lymphodepletierende Chemotherapie erhalten hat, transfundiert. Eine Therapie mit CAR-T-Zellen ist logistisch also sehr aufwendig und derzeit noch an ausgewählte Zentren gebunden.
Indikationen
Bei Erwachsenen sind CAR-T-Zell-Konstrukte derzeit zugelassen für Patienten mit bestimmten rezidivierten/refraktären B-Zell-Lymphomen, mit Rezidiv eines multiplen Myeloms oder Rezidiv einer B-akuten lymphatischen Leukämie (Tab. 1).

Tab. 1 CAR-T-Zell-Konstrukte mit Zulassung in D für die Therapie Erwachsener (Stand 03/25)
Diffuses großzelliges B-Zell Lymphom
Patienten mit diffusem großzelligen B-Zell Lymphom (DLBCL), die auf die Primärtherapie nicht ansprechen oder innerhalb eines Jahres nach Ende der Therapie einen Progress bzw. ein Rezidiv erleiden, haben eine sehr ungünstige Prognose. In zwei randomisierten Studien haben sich gegen CD19-gerichtete CAR-T-Zellen gegenüber dem alten Therapiestandard einer Hochdosistherapie (HDCT) mit autologer Stammzelltransplantation (ASCT) als signifikant überlegen erwiesen (Tab. 2).2-6 In der Studie ZUMA-7 führte eine Therapie mit Axicabtagen-Ciloleucel (Axi-cel) zu einer signifikant höheren Rate kompletter Remissionen (CR, 65% vs. 32%) sowie einem längeren ereignisfreien Überleben (Median 8.3 vs. 2.5 Monate) und Gesamtüberleben (Median nicht erreicht vs. 31.1 Monaten).2-3 Obwohl der Anteil von Patienten mit Grad ≥3 unerwünschten Ereignissen im Axi-cel-Arm höher war als im Vergleichsarm (94% vs. 82%), war die Lebensqualität signifikant besser als unter Standardtherapie.4 Während Lisocabtagen-Maraleucel (Liso-cel) ebenfalls zu einem signifikanten Vorteil im ereignisfreien Überleben (EFS) und progressionsfreien Überleben (PFS) sowie zu einem numerischen Vorteil im Gesamtüberleben führte,5,6 zeigte sich nach Therapie mit Tisagenlecleucel (Tiso-cel) kein Vorteil gegenüber einer HDCT mit ASCT.7
Bereits vor diesen randomisierten Studien waren die drei genannten CAR-T-Zell-Konstrukte für Patienten mit Rezidiv nach mindestens 2 Vortherapien auf Basis von Ergebnissen aus Phase 2-Studien zugelassen worden und stellen in dieser Situation eine wichtige Therapieoption dar.
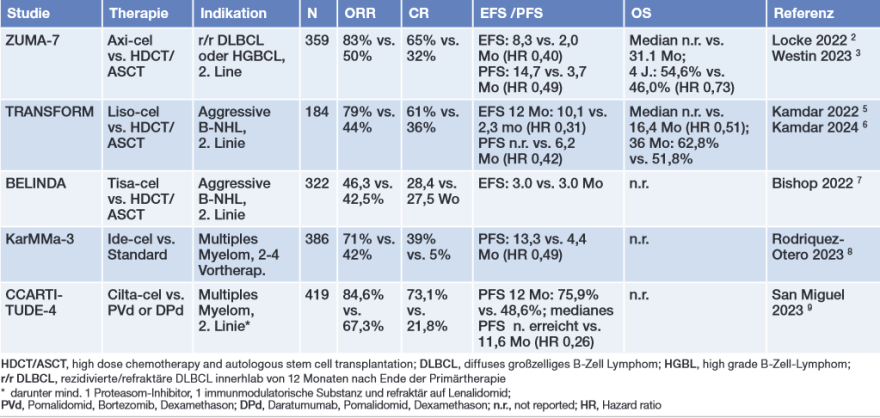
Tab. 2 Ergebnisse aus randomisierten Studien zum Einsatz einer Therapie mit CAR-T-Zellen
Multiples Myelom
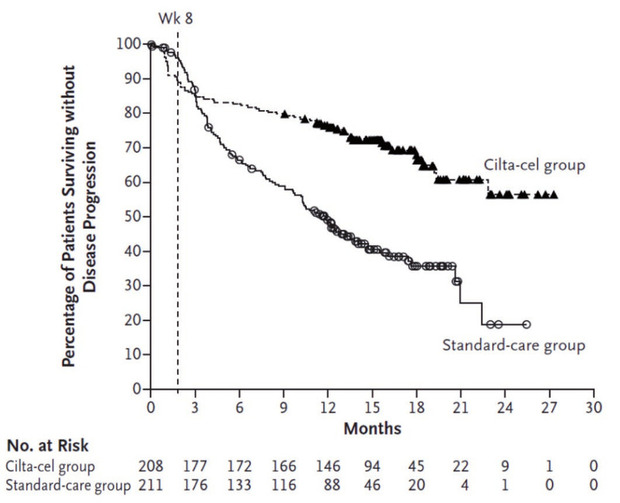
Abb. 2 Progressionsfreies Überleben bei Patienten mit Mutiplem Myelom und 1-3 Vortherapien 9
Für die Therapie von Patienten mit rezidivertem/refraktären (r/r) multiplem Myelom sind zwei Anti-BCMA-CAR-T-Zell-Produkte zugelassen: Idecabtagen vicleucel (Ide-cel) und Ciltacabtagene autoleucel (Cilta-cel). In einer randomisierten Phase III-Studie führte Ide-Cel bei Pat. mit 2-4 Vortherapien zu einem PFS von 13,3 Monaten mit 39% kompletten Remissionen gegenüber 4,4 Monaten und einer CR-Rate von 5% unter einer Standardtherapie und ist für Patienten nach mindestens 2 Vortherapien zugelassen (Tabelle 2).8 Cilta-Cel ist hingegen bereits als Zweitlinientherapie zugelassen für Patienten mit r/r Myelom, sofern die Vorbehandlung eine immunmodulatorische Substanz (IMiD) und einen Proteasominhibitor (PI) eingeschlossen hat und die Patienten unter der letzten Therapie progredient sowie gegenüber Lena-lidomid refraktär sind. Hintergrund sind Ergebnisse der randomisierten CARTITUDE-4-Studie, im Rahmen derer Cilta-cel bei Patienten mit 1-3 Vortherapien im Vergleich zu einer Standardtherapie zu einer signifikant höheren CR-Rate (73,1% vs. 21,8%), einer höheren Rate an MRD-Negativität (60,6% vs. 15,6%) und zu einer signifikanten Verlängerung des PFS geführt hatte (Abb. 2).9
Andere Indikationen
In Europa sind die CD19-CAR-T-Zell-Präparate Axi-cel und Tisa-cel auch zur Dritt- und Viertlinientherapie bei Patienten mit follikulärem Lymphom zugelassen, Brexucabtagen autoleucel zudem für die Drittlinientherapie bei Patienten mit Mantelzelllymphom. Im Rahmen klinischer Studien werden CAR-T-Zellen auch bei soliden Tumoren sowie bei rheumatologischen und neurologischen Erkrankungen geprüft mit zum Teil beeindruckenden Ergebnissen insbesondere bei Autoimmunerkrankungen.
Nebenwirkungen
Zu den häufigen und relevanten Nebenwirkungen einer Therapie mit CAR-T-Zellen zählen das Zytokin-Freisetzungssyndrom (CRS), das Immuneffektorzell-assoziierte Neurotoxizitätssyndrom (ICANS), Infektionen und Zytopenien, die das Risiko für schwere Infektionen weiter erhöhen.
Das Nebenwirkungsprofil der zugelassenen Produkte ist insgesamt ähnlich, weist jedoch einige graduelle Unterschiede auf. Beispielsweise ist der Anteil an Patienten, die ein ICANS ≥ Grad 3 entwickeln, unter Therapie mit Axi-cel höher, als bei Anwendung von Liso-cel oder Tisa-cel.
Zytokin-Freisetzungssyndrom
Ein
CRS tritt als akutes bis subakutes Krankheitsbild in der Regel 2-3
Tage nach Therapie, zum Teil aber auch bereits an Tag 1, selten
verzögert nach wenigen Wochen auf. Es ist Ausdruck der Freisetzung
proinflammatorischer Zytokine wie Interleukin-6, Interleukin-1 oder
TNFa. Leitsymptome sind Fieber nicht-infektiöser Ursache,
Müdigkeit, Übelkeit, grippeähnliche Symptome mit Kopf- und
Gliederschmerzen, Hypotonie oder Atemnot mit Hypoxie. Bei aggressiven
B-Zell-Lymphomen bzw. DLBCL ist die Inzidenz eines CRS hoch (ca. 90%
unter Axi-cel, ca. 60% unter Tisa-cel und 50% unter Liso-cel),
schwergradige Verläufe (≥ Grad 3) sind jedoch deutlich seltener.
Es gibt sowohl Patienten-assoziierte Risikofaktoren für das
Auftreten eines CRS wie z.B. eine hohe Tumorlast oder Komorbiditäten,
wie auch behandlungsassoziierte Faktoren wie die Art des
CAR-Targetantigens (CD19 > CD22/BCMA) oder die Dosis der
transfundierten CAR-T-Zellen (2×106 – 2×108/kg KG).10
Therapie der Wahl ist die Gabe des IL-6-Rezeptor-Antagonisten Tocili-zumab. Bei unzureichender Wirkung kommen Kortikosteroide und gegebenenfalls Anakinra zum Einsatz. Die Graduierung und Therapie des CRS richtet sich nach nationalen und internationalen Leitlinien.10-14
ICANS
Ein ICANS entwickelt sich meist 5-6 Tage, sehr selten auch spät bis zu 4 Wochen nach Gabe der Therapie, oft gleichzeitig mit einem CRS oder mit kurzem zeitlichen Verzug.10 Unter Therapie mit Axi-cel tritt ein ICANS bei bis zu 64% aller Patienten auf, die Rate schwerwiegender Verläufe (≥Grad 3) liegt jedoch unter 30%. Neurologische Störungen reichen von leichten Symptomen wie Schläfrigkeit oder leichter Desorientiertheit bis hin zu ausgeprägter Verwirrtheit, Dysphasie, Aphasie, Krampfanfällen und Störungen der motorischen Funktion, sofern keine adäquate Therapie erfolgt. Für die Beurteilung eines ICANS wird der 10 Punkte Immune Effector Cell Encephalopathy Score (ICE-Score) herangezogen.12-14 Die Therapie basiert auf Gabe von Kortikosteroiden (primär Dexamethason) und richtet sich nach dem Schweregrad (Abb. 3). Gegebenenfalls ist auch die Gabe nicht sedierender antiepileptischer Medikamente wie z.B. Levetiracetam sinnvoll. Liegt gleichzeitig ein CRS vor, erfolgt die Behandlung entsprechend der in Leitlinien vorgegebenen Algorithmen einer CRS-Therapie.
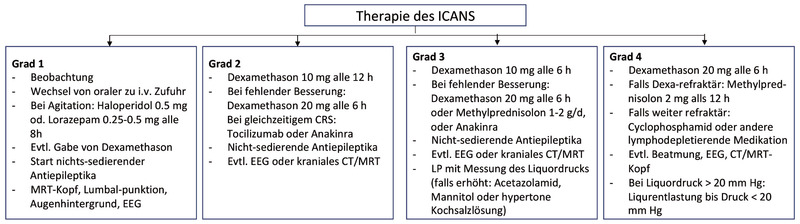
Abb. 3 Empfehlungen zur Therapie des ICANS 13; ASTCT-Graduierung siehe 12
Infektionen
Neben der T-Zell-Suppression durch die lymphodepletierende Vortherapie und ggfls. Therapie eines CRS/ICANS mit Dexamethason weisen Patienten nach CAR-T-Zell-Therapie eine massive B-Zell-Suppression auf. Hieraus ergibt sich deutlich erhöhtes Risiko für bakterielle, virale und fungale Infektionen.11-15 Obligat sind eine PjP-Prophylaxe mit Cotrimoxazol und eine HSV/VZV-Prophylaxe mit Aciclovir/Valaciclovir. Zudem sollte ein CMV-Monitoring erfolgen und der IgG-Spiegel überwacht werden mit Substitution von Immunglobulinen, wenn der IgG-Serumspiegel unter 4 g/l (400 mg/dl) abfällt. Wichtig ist zudem ein ausreichender Impfstatus zumindest gegen Covid-19, Influenza und Pneumokokken.
Zytopenien
Sehr häufig entwickeln sich zum Teil lang anhaltende Zytopenien als Ausdruck eines Immuneffektor-Zell-assoziierten Hämatotoxizität (ICAHT). Anhand des sog. CAR-HEMATOTOX scores kann anhand von 5 Kriterien (Zahl der Thrombozyten, Zahl der Neutrophilen, Hämoglobin, CrP, Ferritin) eine Niedrig- von einer Hochrisikogruppe unterschieden werden.16 Die zwei Gruppen weisen große Unterschiede in Bezug auf die Zytopeniendauer (3-6 Tage vs. 9-14 Tage) und die Rate schwerer Infektionen (5-8% vs. 30-40%) auf. Neben der Gabe von Blutprodukten, kann eine Therapie mit hämatopoetischen Wachstumsfaktoren (G-CSF, Erythropoetin) sinnvoll sein und im Zweifelsfalle auch die Reinfusion eines autologen Stammzell-Back-Ups.
Einsatz bei HIV
CAR-T-Zellen stellen anders als herkömmliche Medikamente ein individuelles biologisches Produkt dar. Diese Produkte werden als „Advanced Therapy Medicinal Product“ bezeichnet.
Ein Advanced Therapy Medicinal Product, abgekürzt ATMP, ist – wörtlich – ein Arzneimittel für neuartige Therapien. Der Begriff wurde 2007 in die Gesetzgebung eingeführt, um Sonderregeln für diese sehr heterogene Gruppe von Arzneimitteln zu definieren. Man unterscheidet drei Arten von ATMP:
- Gentherapeutika gemäß EU-Verordnung 2001/83
- Somatische Zelltherapeutika gemäß EU-Verordnung 2001/83
- Biotechnologisch bearbeitete Gewebeprodukte gemäß EU-Verordnung 1394/2007
Menschen mit HIV (PLWH) weisen auch unter einer modernen ART ein ca. 10-20-erhötes Risiko für die Entwicklung eines aggressiven B-Zell-Lymphoms auf.17,18 In der westlichen Welt sind Non-Hodgkin-Lymphome die häufigste AIDS-assoziierte Todesursache. Da eine HIV-Infektion in den bisherigen klinischen Studien zur CAR-T-Zell-Therapie ein Ausschlusskriterium darstellte, beschränken sich die Erfahrungen mit dieser Therapie bei PLWH und DLBCL auf kleinere Fallserien und retrospektive Analysen.19,20 Eingesetzt wurde bisher nur das mithilfe eines Gamma-Retrovirus transfizierte CAR-T-Zellprodukt Axicabtagen-Ciloleucel (Axi-cel). Aus den vorliegenden Berichten geht hervor, dass eine Therapie mit CAR-T-Zellen bzw. mit Axi-cel auch bei PLWH gut machbar ist. Von sechs Patienten mit HIV-DLBCL, die mit Axi-Cel behandelt wurden, war bei vieren keine Viruslast nachweisbar und die mediane CD4-Zellzahl lag bei 221/µl (52-629).19 Es ergaben sich keine Hinweise auf eine im Vergleich zum Einsatz bei Personen ohne HIV verminderte Wirksamkeit oder auf erhöhte Toxizitätsraten. In einer US-Amerikanischen Kohortenstudie wurden 21 PLWH analysiert, die wegen eines DLBCL (n=19) oder anderen Lymphomen (n=2) mit Axi-cel (n=20) oder Brexu-cel (n=1) behandelten wurden. Die mediane Zahl CD4+ T-Helferzellen vor CAR-T-Zelltherapie betrug 228/µl (0-252) und bei 8 von 10 Patienten war keine Viruslast nachweisbar. Auch in dieser Auswertung zeigten sich in Bezug auf Toxizität und Wirksamkeit der Therapie keine Unterschiede zum Einsatz von CART bei PLWH im Vergleich zum Einsatz bei Lymphom-Patienten ohne HIV.20
Die Verwendung von Axi-cel bei HIV-DLBCL wurde von den Kostenträgern bisher jedoch zumeist abgelehnt mit der Argumentation, dass es hierzu keine Erfahrungen aus klinischen Studien gibt. Dieser Einschätzung stehen jahrzehntlange Erfahrungen sowie Empfehlungen nationaler und internationaler Leitlinien entgegen, denen zufolge sich die antineoplastische Therapie bei PLWH nicht unterscheiden sollte von den Therapien, die bei Patienten ohne HIV etabliert sind.17,18 In spezialisierten Tumorboards sollte auf diese Empfehlungen unbedingt hingewiesen und Ausnahmen sollten gut begründet werden.
Bemerkenswerter- und erfreulicherweise stellt eine HIV-Infektion bei den aktuellen ZUMA-Folgestudien zum Einsatz einer CAR-T-Zelltherapie bei DLBCL und anderen Lymphom-Entitäten (ZUMA-22, -23 und -25) kein Ausschlusskriterium mehr dar.
Auch die Deutsche Gesellschaft für Hämatologie und Onkologie (DGHO) und die Deutsche Gesellschaft für Infektiologie (DGI) haben sich in entsprechenden Stellungnahmen dafür eingesetzt, HIV-positiven Patienten mit DLBCL den Zugang zu einer CAR-T-Zell-Therapie zu ermöglichen.21
Literatur
1 Poojary R, Song AF, Shine Sond B, et al. Investigating chimeric antigen receptor T cell therapy and the potential for cancer immunotherapy (Review). Mol Clin Oncol 2023;19:95
2 Locke FL, Miklos DB, Jacobson CA, et al. Axicabtagene ciloleucel as second-line therapy for large B-cell lymphoma. N Engl J Med 2022;386:640–54
3 Westin IR, Oluwole OO, Kersten MJ, et al. Survival with axicabtagene ciloleucel in large B-cell lymphoma. New Engl J Med 2023;389:148-57
4 Westin JR, Locke FL, Dickinson M et al. Safety and efficacy of axicabtagene ciloleucel versus standard of care in patients 65 years of age or older with relapsed/refractory large B-cell lymphoma. Clin Cancer Res 2023;29:1894-905
5 Kamdar M, Solomon SR, Arnason J, et al. Lisocabtagene maraleucel versus standard of care with salvage chemotherapy followed by autologous stem cell transplantation as second-line treatment in patients with relapsed or refractory large B-cell lymphoma (TRANSFORM): results from an interim analysis of an open-label, randomised, phase 3 trial. Lancet 2022; 399: 2294-308
6 Kamdar MK, Solomon SR, Arnason J, et al. Lisocabtagenemaraleucel (liso-cel) vs standard of care (SOC) with salvage chemotherapy (CT) followed by autologous stem cell transplantation (ASCT) as second-line (2L) treatment in patients (pt) with R/R large B-cell lymphoma (LBCL): 3-year follow-up (FU) from the randomized, phase 3 TRANSFORM study. ASCO Annual Meeting 2024: abstract #7013
7 Bishop MR, Dickinson M, Purtill D, et al. Second-line tisagenlecleucel or standard care in aggressive B-cell lymphoma. N Engl J Med 2022;386:629-39.
8 Rodriguez-Otero P, Ailawadhi S, Arnulf B, et al. (2023) Ide-cel or standard regimens in relapsed and refractory multiple myeloma. N Engl J Med 388:1002-14
9 San-Miguel J, Dhakal B, Yong K, et al. Cilta-cel or standard care in lenalidomide-refractory multiple myeloma. N Engl J Med 2023;389:335-47
10 Bücklein V, von Tresckow B, Subklewe M. T-Zell-rekrutierende Immuntherapien des B-Zell Lymphoms – bald in allen Therapielinien? Dtsch Med Wochenschr 2024;149: 630–7
11 Hayden PJ, Roddie C, Bader P et al. Management of adults and children receiving CAR T-cell therapy: 2021 best practice recommendations of the European Society for Blood and Marrow Transplantation (EBMT) and the Joint Accreditation Committee of ISCT and EBMT (JACIE) and the European Haematology Association (EHA). Ann Oncol 2022;33:259-75
12 Lee DW, Santomasso BD, Locke FL, et al. ASTCT consensus grading for cytokine release syndrome and neurologic toxicity associated with immune effector cells. Biol Blood Marrow Transplant 2019;25:625-38
13 Ludwig H, Terpos E, van de Donk N, et al. (2023) Prevention and management of adverse events during treatment with bispecific antibodies and CAR T cells in multiple myeloma: a consensus report of the European Myeloma Network. Lancet Oncol 24:e255-69
14 Onkopedia Leitlinie. CAR-T Zellen: Management von Nebenwirkungen. Juni 2020 https://www.onkopedia.com/de/onkopedia/guidelines/car-t-zellen-management-von-nebenwirkungen/@@guideline/html/index.html
15 Stewart AG, Henden AS. Infectious complications of CAR T-cell therapy: a clinical update. Ther Adv Infect Dis 2021;8: 20499361211036773.
16 Rejeski K, Subklewe M, Aljurf M, et al. Immune effector cell–associated hematotoxicity: EHA/EBMT consensus grading and best practice recommendations. Blood 2023;142:865-77
17 Onkopedia Leitlinie HIV Lymphome. September 2022. https://www.onkopedia.com/de/onkopedia/guidelines/hiv-assoziierte-lymphome/@@guideline/html/index.html
18 Hübel K, Bower M, Aurer I, et al. Human immunodeficiency virus-associated Lymphomas: EHA-ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Hemasphere. 2024 Sep 3;8(9):e150
19 Hattenhauer ST, Mispelbaum R, Hentrich M, et al. Enabling CAR T-cell therapies for HIV-positive lymphoma patients – a call for actions. HIV Med 2023;24:957-64
20 Barta SK, Noy A, Pasquini MC, et al. Observational cohort study of people living with HIV (PWH) treated with CD19-directed CAR T cell therapy for B-cell lymphoid malignancies – interim results of AIDS Malignancy Consortium (AMC) Study AMC-113. Blood 2022;140 (Suppl.1):1847-8
21 https://www.dgho.de/publikationen/stellungnahmen/gute-aerztliche-praxis/car-t-zelltherapie/dgho-stellungnahme-axi-cel.pdf









 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen