Lea Grote-levi, Sandra Nay, Nora Möhn, Thomas Skripuletz, Hannover
Virus-spezifische T-Zelltherapie bei PML
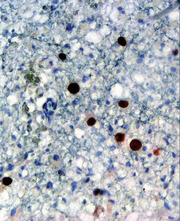
Abb. 1 Immunhistochemischer Nachweis von JC-Virusprotein (braun angefärbt) in einer Hirn-biopsie bei PML © wikimedia.org, Marvin 101, Auswahl andmore-Media
Die progressive multifokale Leukenzephalopathie (PML) ist eine lebensbedrohliche opportunistische Infektion des zentralen Nervensystems und gleichzeitig eine AIDS-definierende Erkrankung. Sie wird durch das JC-Virus (John-Cunningham-Virus, JCV), das auch als Humanes Polyomavirus 2 bekannt ist, ausgelöst. Es wird angenommen, dass die Primärinfektion mit dem JC-Virus bereits im Kindesalter über die oropharyngeale Schleimhaut erfolgt und zu einer lebenslangen, asymptomatischen Viruspersistenz führen kann.1
Betroffen von einer PML sind insbesondere Personen mit geschwächtem Immunsystem.1
Bei Patienten mit zellulärer Immundefizienz, beispielsweise einer HIV-Infektion mit fortgeschrittenem Immundefekt ohne antiretrovirale Therapie (ART), kann es durch virale genetische Veränderungen zu einer Reaktivierung des Virus kommen, welche bei unzureichender Immunantwort die Entwicklung einer PML zur Folge hat. Es sind aber auch bei Patienten mit einer unter ART kontrollierten HIV-Infektion bei persistierender Lymphozytopenie PML-Fälle dokumentiert.1-4
Diagnose
Die definitive Diagnosestellung der PML erfolgt bei passender klinischer Symptomatik und typischen bild-morphologischen Veränderungen in der zerebralen Magnetresonanztomographie (MRT) durch den Nachweis von JCV im Liquor. Alternativ kann, beispielsweise bei fehlendem Virusnachweis im Liquor, eine Hirnbiopsie zur Bestätigung der Diagnose durchgeführt werden. Sonderformen wie die JCV-Körnerzellneuronopathie mit klinisch führendem zerebellären Syndrom/Hirnstammsyndrom und fehlenden supratentoriellen Marklagerläsionen sind ebenfalls beschrieben.5-7
Prognose
Aktuell gibt es keine zugelassene antivirale Therapie für die PML.1,3 Das primäre Therapieziel besteht darin, das kompromittierte Immunsystem der Betroffenen zu stabilisieren, beispielsweise durch die Etablierung einer ART.8 Bei schnell fortschreitenden Formen der PML und somit möglicherweise zu spät einsetzendem Therapieerfolg der ART, führt die Erkrankung jedoch weiterhin zu einem hohen Morbiditätsgrad. Auch die Mortalitätsrate liegt bei Personen mit PML bei HIV trotz ART weiterhin bei bis zu 40%.8,9
Neue Ansätze
In den letzten Jahren haben zwei innovative Therapieansätze vielversprechende Ergebnisse gezeigt: Zum einen die Immuncheckpoint-Inhibition mit beispielsweise Pembrolizumab und zum anderen der adoptive Transfer von virusspezifischen T-Zellen. Beide Verfahren zielen darauf ab, das Fortschreiten der PML zu stoppen und die Bildung von Narben zu minimieren, die die verbleibende symptomatische Ausprägung der Erkrankung beeinflussen.1 Im folgenden Abschnitt wird nun näher auf den Ansatz der allogenen virusspezifischen T-Zelltherapie eingegangen.
Erste Erfolge
Der erste erfolgreiche Fall einer Behandlung von PML-Patienten mit allogenen virusspezifischen T-Zellen wurde 2011 veröffentlicht.10 Nach der Veröffentlichung einer Fallserie mit drei PML-Patienten im Jahr 2018 zeigte eine Pilotstudie aus dem Jahr 2021 ein Therapieansprechen bei 58% der behandelten Patienten.11 In einer weiteren, im Oktober 2024 veröffentlichten Fallserie wiesen 22 von 28 behandelten Patienten (79%) ein positives Therapieansprechen auf die individuelle Behandlung mit direkt isolierten, allogenen virusspezifischen T-Zellen (DIAVIS T-Zellen) auf. Bei diesen Patienten, die zuvor einen Krankheitsprogress zeigten, kam es zu einer Stabilisierung des Krankheitsverlaufs oder einer Verbesserung der neuro-logischen Symptome.3 Kürzlich berichteten ebenfalls Kollegen aus Neuseeland und Australien in einer multizentrischen Studie über den Therapieerfolg virusspezifischer T-Zellen bei verschiedenen viralen Infektionen, einschließlich der PML.12
Herstellungsverfahren
Für die Herstellung allogener virusspezifischer T-Zell-Produkte im Rahmen der personalisierten Medizin zur Behandlung der PML kommen verschiedene Herstellungsverfahren zum Einsatz. Im Fokus steht hier der vielversprechende Ansatz der direkten Zell-Isolation.
Voraussetzung für die Herstellung ist zunächst die Identifikation eines HLA-kompatiblen Spenders, bei dem eine ausreichende Ausgangsfrequenz virusspezifischer Gedächtnis-T-Zellen vorhanden ist. Ursprünglich konzentrierte sich die Spenderauswahl auf geeignete Stammzellspender, die nach einer Stammzelltransplantation im Zusammenhang mit PML bei lymphoproliferativen Erkrankungen zur Verfügung standen. In den letzten Jahren wurden jedoch zunehmend auch Familienspender sowie unverwandte Drittspender auf ihre Eignung hin überprüft.3,11,13 Falls geeignete Familien-Spender nicht verfügbar sind, bieten T-Zell-Fremdspenderregister wie das alloCELL-T-Zellspenderregister eine optimierte Möglichkeit zur Identifikation eines passenden unverwandten Drittspenders. Das Register kombiniert HLA-Typisierungen mit T-Zell-Frequenzanalysen für verschiedene virale Erreger, die im Rahmen von Blutspenderanalysen durchgeführt werden.3,14,15
Nach der Identifikation eines geeigneten Spenders ermöglicht die MACS®-Technologie (Magnetic-Activated Cell Sorting) die präzise Aufreinigung von T-Zellen. Diese Technologie, die beispielsweise im CliniMACS® Cytokine Capture System (CCS) eingesetzt wird, nutzt die Aktivierung der T-Zellen mit viralen Peptidpools und deren anschließende Interferon-gamma-Produktion zur magnetischen Isolierung des finalen Zellprodukts.3,13,16-18 Das Zellprodukt steht dann innerhalb von 16-24 Stunden nach Leukapherese zur Übertragung auf die betroffene Person zur Verfügung.3,7,13,15,19
Standen zunächst spezifische virale Peptidpool nur gegen das artverwandte BK Polyomavirus (BK-Virus, BKV) in Good Manufacturing Practice (GMP)-Qualität zur Verfügung, können mittlerweile ebenfalls Peptidpools des eigentlichen JC-Virus in GMP-Standard verwendet werden. Als Grundlage der Nutzung von BKV-spezifischen Peptiden zur Zell-Produkt-Herstellung und Anwendung im Kontext der PML steht hier die hohe Sequenzhomologie der beiden Polyomavirusstämme.3,11,20,21
Das Verfahren der direkten Isolation (sogenannte „directly isolated virus-specific T cells, DIAVIS T cells) zeigt, trotz einer geringen Gesamtzahl virusspezifischer T-Zellen gegenüber ex vivo Expansionsverfahren, vielversprechende Therapieerfolge im Kontext der PML im Vergleich zu einer „best-supportive treatment“-Kohorte.3
Neben allogenen T-Zellen, die auf einen einzelnen Virusstamm gerichtet sind, ermöglicht dieses Verfahren auch die Herstellung multi-virusspezifischer T-Zellen, die gegen mehrere Viren gleichzeitig gerichtet sind. Ein Beispiel hierfür ist die erfolgreiche Behandlung eines Patienten mit AIDS, PML und EBV-Infektion, bei dem multi-virusspezifische T-Zellen gegen BKV und EBV eingesetzt wurden und der Patient wieder seine Gehfähigkeit erlangte.19
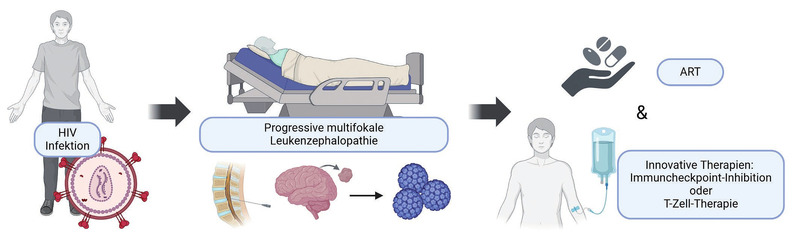
Abb. 2 Innovative Therapieverfahren bei der PML (Created in BioRender. Grote-levi, L. (2025) https://BioRender.com/b21s047)
Potentielle Nebenwirkungen
Vor
der Applikation allogener virusspezifischer T-Zell-Therapien ist
keine spezielle Vorbereitung des Immunsystems erforderlich. Die
möglichen Nebenwirkungen beziehen sich daher hauptsächlich auf das
T-Zell-Produkt selbst und den erwarteten Therapieeffekt. Die
Transfusion von allogenen Fremdblutprodukten birgt allgemeine Risiken
wie Transfusionsreaktionen, allergische Reaktionen sowie die
Entwicklung einer Graft-versus-Host-
Reaktion (GvHD). Die
Auswahl eines geeigneten Spenders, der eine möglichst hohe
HLA-Kompatibilität aufweist, sowie die Transfusion einer geringeren
Anzahl von Zielzellen zielen darauf ab, das Risiko einer GvHD zu
minimieren, indem die Übertragung alloreaktiver T-Lymphozyten
reduziert wird.15,22-24
Im Kontext der PML kann die Verabreichung virusspezifischer T-Zellen neben der gewünschten Rekonstitution des Immunsystems auch ein sogenanntes Immun-Rekonstitutions-Inflammations-Syndrom (IRIS) auslösen, bei dem es zu einer überschießenden Immunantwort kommt.1,3,11 Klinisch äußert sich dies in einer Verschlechterung der Symptome mit begleitender Inflammation in der cerebralen MRT durch Darstellung von kontrastmittelaufnehmenden Läsionen und/oder Ödem.1,2 Im Vergleich zu PML-Fällen, die durch Natalizumab und das Absetzen des Medikaments ausgelöst werden, fällt das PML-IRIS im Kontext der T-Zell-Therapie meist weniger schwerwiegend aus. Eine mögliche Therapie mit Glukokortikoiden sollte sorgfältig abgewogen werden, da sie das T-Zell-Produkt schwächen könnte. Nach den bisherigen Erfahrungen ist der Einsatz von Steroiden jedoch meist nicht erforderlich, da die Symptome in der Regel mild sind.
Zusammenfassung
Die progressive multifokale Leukenzephalopathie (PML) ist eine lebensbedrohliche Infektion des zentralen Nervensystems, die vor allem Personen mit geschwächtem Immunsystem, insbesondere auch HIV-Patienten, betrifft. Sie wird durch das John-Cunningham-Virus (JC-Virus) ausgelöst und kann auch bei Patienten mit stabilisierter Viruslast unter antiretroviraler Therapie auftreten. Derzeit steht keine zugelassene Therapie für die PML zur Verfügung. Die Therapiestrategie beruht auf einer Stabilisierung des Immunsystems. In den letzten Jahren haben sich allogene virusspezifische T-Zellen als vielversprechender Ansatz erwiesen, der bei Betroffenen zu einem Stopp der PML sowie teils Verbesserung der neurologischen Symptome führte. Ein sehr schnelles, effektives T-Zell-Herstellungsverfahren fußt auf der direkten Isolation und konsekutiven Anreicherung HLA-kompatibler virusspezifischer T-Zellen innerhalb von 16-24h (sogenannte DIAVIS T cells) und erzielte vielversprechende Therapieerfolge im Kontext der PML.
Kontraindikation: PML-IRIS
Bei Manifestation der PML im Rahmen der Erstdiagnose einer HIV-Infektion oder im Rahmen eines AIDS ohne dauerhafte ART kann sich unter neu etablierter ART ebenfalls ein PML-IRIS zeigen.9 Eine zusätzliche Stimulation des Immunsystems mit innovativen Therapieverfahren wie beispielsweise der allogenen virusspezifischen T-Zell-Therapie ist dann nicht mehr notwendig. Neben dem Indikator des schnellen CD4+-T-Zell-Anstiegs1,9, stehen weitere eindeutige prädiktive Parameter zur Vorhersage des PML-Krankheitsverlaufs, im Sinne des Auftretens eines PML-IRIS nach Beginn einer ART, aktuell nicht zur Verfügung. Insgesamt zeigt sich jedoch, dass besonders bei Patienten mit Inflammation häufig ein positiver Therapieverlauf verzeichnet werden kann, ein letaler Ausgang ist jedoch ebenfalls möglich.2
Ausblick
Neben der Anwendung allogener mono- oder multi-virusspezifischer T-Zellen werden derzeit auch andere Zelltherapien intensiv erforscht, wie zum Beispiel autologe, genetisch modifizierte T-Zell-Produkte, die modifizierte T-Zell-Rezeptoren (TCR) oder chimäre Antigenrezeptoren (CAR) exprimieren. Diese Ansätze werden insbesondere im Kontext maligner und autoimmuner Erkrankungen untersucht.25-29 Ein weiteres Beispiel hierfür ist die intensive Forschung an löslichen bispezifischen TCR zur dauerhaften Suppression von HIV.30
Literatur beim Verfasser









 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen